-
Numero contenuti
14587 -
Iscritto
-
Ultima visita
Tipo di contenuto
Profili
Forum
Orchidee
Diventa Socio
Calendario
Tutti i contenuti di Archivio Micologico
-

Laccaria laccata (Scop. : Fr.) Cooke 1884
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Commestibili
Laccaria laccata (Scop. : Fr.) Cooke; Regione Marche; Novembre 2004; Foto di Pietro Curti. Imenoforo, gambo e pileo. -

Squamanita schreieri Imbach 1946
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Squamanita schreieri Imbach; Regione Umbria; Settembre 2020; Foto di Tomaso Lezzi. (Exsiccatum TL200901-01) Specie parassita di Amanita strobiliformis Paulet ex Vittad. Il gambo termina con una estremità napiforme formata dall'unione dei tessuti della Squamanita parassita e dell’Amanita parassitata, che è stata definita nel tempo e da vari autori in modi differenti. La definizione più recente ed accreditata è mycocecidium (VIZZINI 2014), che in questa specie si presenta bianco, appuntito all'estremità e decorato da squame disposte in cercini soprattutto sulla parte più alta del mycocecidium. Nota Per maggiori dettagli riguardo a questo ritrovamento si può consultare il recente articolo in versione bilingue inglese e italiana: LEZZI, T. & GALEOTTI, G., 2022. Description of two Italian records ofSquamanita schreieri. RMR, Boll. Amer 115, Anno XXXVIII, 2022 (1): 31-38. [Data di accesso: 10/01/2023]. LEZZI, T. & GALEOTTI, G., 2022. Descrizione di due ritrovamenti in Italia di Squamanita schreieri. RMR, Boll. Amer 115, Anno XXXVIII, 2022 (1): 31-38. [Data di accesso: 10/01/2023]. All'interno dell'articolo sono disponibili la descrizione dettagliata del ritrovamento, e una discussione più approfondita. Bibliografia LEZZI, T. & GALEOTTI, G., 2022. Description of two Italian records ofSquamanita schreieri. RMR, Boll. Amer 115, Anno XXXVIII, 2022 (1): 31-38. [Data di accesso: 10/01/2023]. LEZZI, T. & GALEOTTI, G., 2022. Descrizione di due ritrovamenti in Italia di Squamanita schreieri. RMR, Boll. Amer 115, Anno XXXVIII, 2022 (1): 31-38. [Data di accesso: 10/01/2023]. LIU, J.-W., GE, Z.-W., HORAK, E., VIZZINI, A., HALLING, R.E., PAN, C.-L. & YANG, Z.-L., 2021. Squamanitaceae and three new species of Squamanita parasitic on Amanita. IMA Fungus 12: 4. https://doi.org/10.1186/s43008-021-00057-z [Data di accesso: 29/01/2020]. SCHREIER, L., 1938 Tricholoma X. Schweizerischen Zeitschrift für Pilzkunde 7: 97-100. VIZZINI, A. & GIRLANDA, M., 1997. Squamanita umbonata (Sumst.) Bas, a mycoparasite of Inocybe oblectabilis (Britz.) Sacc. Allionia 35: 171-175. VIZZINI, A., 2014. Index Fungorum 166. La carne del mycocecidium si mostra più grigiastra che nel resto della sezione, perché è formata sia dai tessuti dell'Amanita strobiliformis parassitata, che da quelli della Squamanita schreieri che la sta parassitando. -

Squamanita schreieri Imbach 1946
Archivio Micologico ha postato un topic nell'area Funghi Non Commestibili o Sospetti
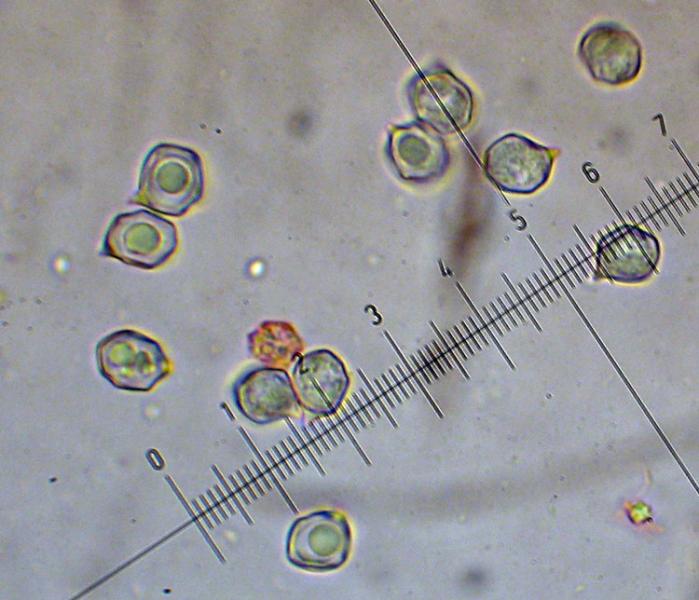
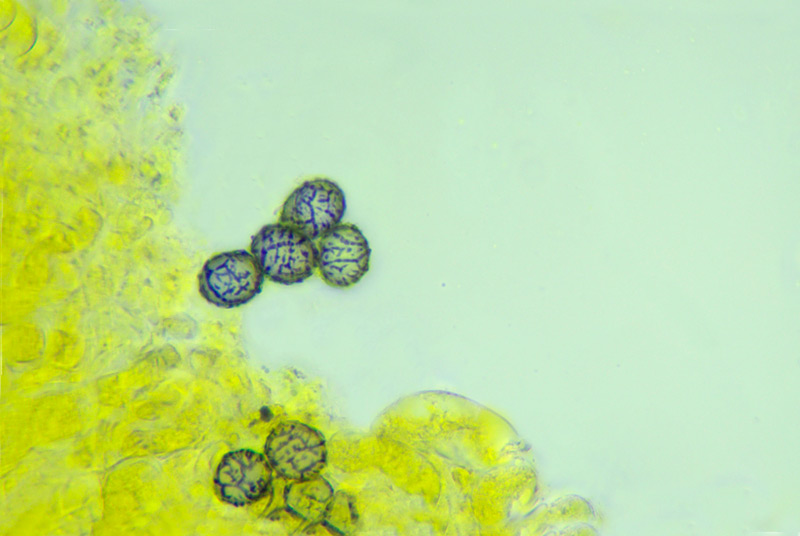
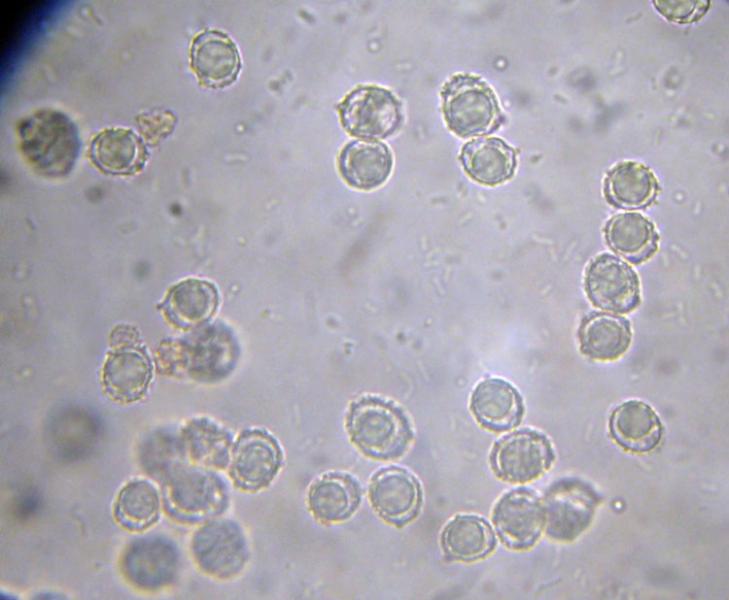
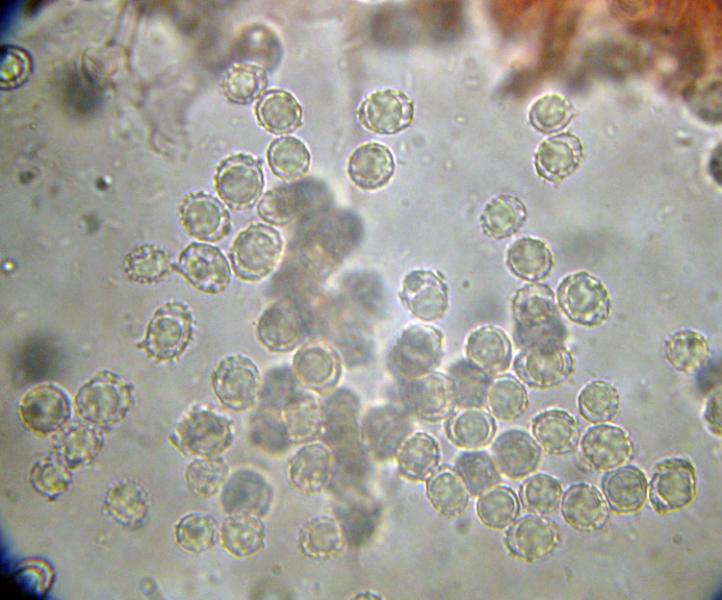
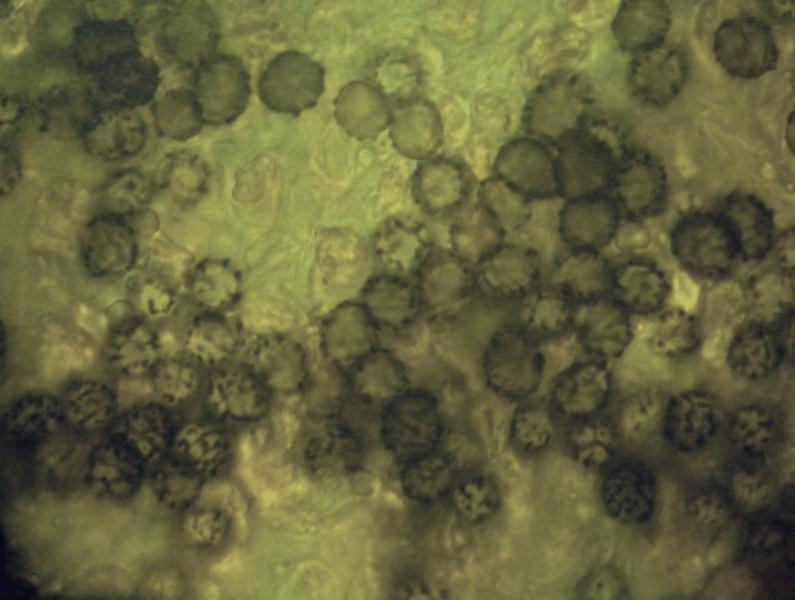
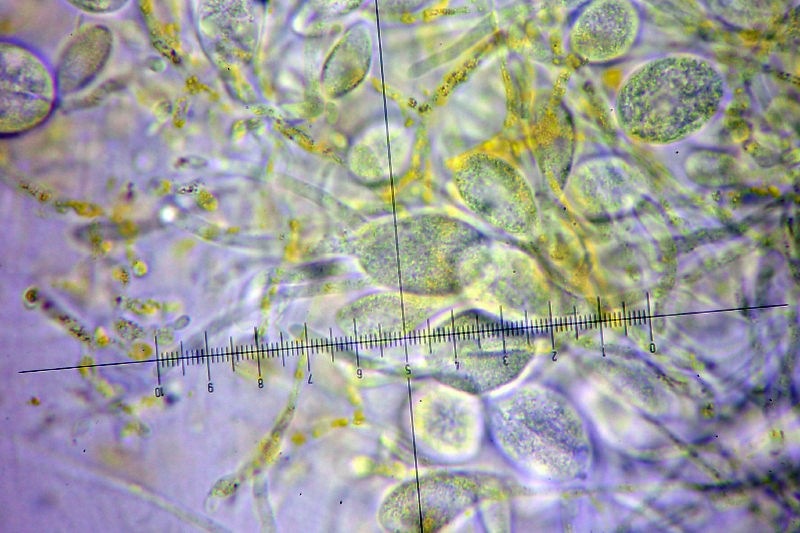
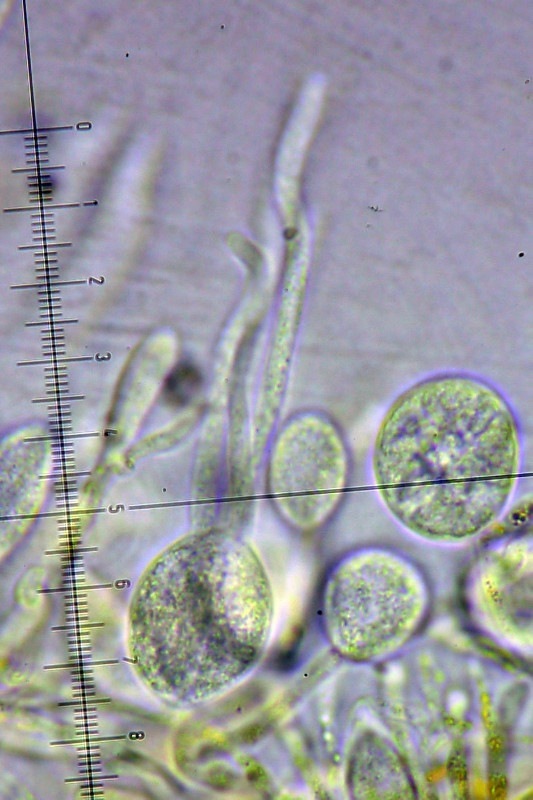
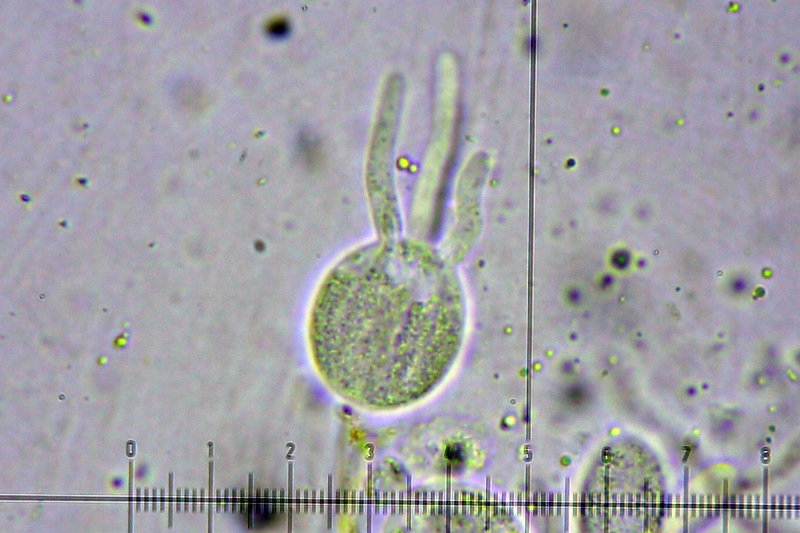
Squamanita schreieri Imbach 1946 Tassonomia Divisione Basidiomycota Classe Agaricomycetes Ordine Agaricales Famiglia Squamanitaceae Etimologia L'epiteto Squamanita deriva da la latino squama = squama e dal nome di genere Amanita (dal greco Ἀμανὶτης [Amanitos] = fungo del monte Amano, da Ἄμανος [Amanos] = Amano, catena di monti tra la Cilicia e la Siria, nella Turchia asiatica, dove questa specie sembra fosse abbondante in antichità) per l'aspetto simile ad una Amanita con il cappello squamoso. L'epiteto schreieri è dedicato al micologo Leo Schreier, che ne descrive un roitrovamento nella rivista Schweizerischen Zeitschrift für Pilzkunde 1938 7: 97-100. Cappello Cappello convesso, con basso umbone schiacciato, presenta squame appressate di color arancio ruggine, distribuite radialmente sul cappello che lasciano intravedere a zone la carne bianca sottocuticolare. Il margine risulta eccedente e appendicolato. Imenoforo Lamelle da adnate a uncinate, decorrenti per un dentino, fitte, basse bianche, invecchiando diventano ocracee e presentano filo irregolare ed eroso più chiaro rispetto alle facce, sono presenti lamellule di diversi ordini. Gambo Cilindrico, tozzo, biancastro, ornato da squame color arancio ruggine, con una zona subanulare. Termina con una estremità napiforme formata dall'unione dei tessuti della Squamanita parassita e dell’Amanita parassitata, che è stata definita nel tempo e da vari autori in modi differenti. La definizione più recente ed accreditata è mycocecidium (VIZZINI 2014), che in questa specie si presenta bianco, appuntito all'estremità e decorato da squame disposte in cercini soprattutto sulla parte più alta del mycocecidium. Carne Carne biancastra nella sezione dello stipite e del pileo, grigiastra nel bulbo. Odore pungente sgradevole, con sentore di pesce. Habitat Questa specie è parassita di Amanita strobiliformis (Paulet ex Vittad.) Bertill. ed è quindi legata agli ambienti di crescita di quest'ultima specie. Microscopia Pileipellis un trichioderma formato da ife che contengono un pigmento precipitato all’interno delle cellule, frammiste ad ife oleifere. Basidi tetrasporici, clavati. Spore (4,6) 4,8-6,5 (7,6) × (3,4) 3,7-4,8 (5,4) μm; Q = (1,0) 1,2-1,6 (1,7); N = 52; Media = 5,8 × 4,2 μm; Qm = 1,4; ellissoidali, guttulate, a parete sottile, lisce, inamiloidi, ortocromatiche, biancastre in massa. Clamidospore (8,7) 8,73-9,2 (9,3) × (8,4) 8,5-9,0 (9,1) μm; Q = (1,0) 1,01-1,06 (1,1); N = 12; Media = 9,0 × 8,8 μm; Qm = 1,0; globose, con superficie verrucosa, rare, osservate nei tessuti della pileipellis. Trama lamellare subparallela. Cistidi assenti. GAF abbondanti, presenti alla base dei basidi e negli altri tessuti. Commestibilità e tossicità Non commestibile. Specie simili Il genere Squamanita comprende 15 specie (http://www.indexfungorum.org) che parassitano almeno 7 generi diversi, non strettamente imparentati tra di loro: Amanita, Cystoderma, Galerina, Hebeloma, Inocybe, Kuehneromyces, Phaeolepiota e forse Mycena (Liu et al. 2021). Di queste 15 specie 3 sono state descritte abbastanza recentemente: S. mira, S. orientalis e S. sororcula (Liu et al. 2021). Le specie più simili a S. schreieri sono S. mira, S. orientalis e S. sororcula. S. schreieri si differenzia dalle altre Squamanita per i seguenti caratteri: S. granulifera Bas & Læssøe, S. contortipes (A.H. Sm. & D.E. Stuntz) Heinem. & Thoen e S. fimbriata Gulden, Bendiksen & Brandrud hanno spore amiloidi. S. squarrulosa G.S. Ridl. e S. mira J.W. Liu & Zhu L. Yang hanno la base del gambo che emerge da un mycocecidium simile a una volva. S. orientalis J.W. Liu & Zhu L. Yang, S. sororcula J.W. Liu & Zhu L. Yang, S. umbonata (Sumst.) Bas e S. citricolor Thoen hanno cistidi imeniali. S. pearsonii Bas, S. paradoxa (A.H. Sm. & Singer) Bas, S. umbilicata Harmaja, S. odorata (Cool) Imbach e S. basii Harmaja hanno diametro del cappello inferiore a 5 cm. Nota Per maggiori dettagli riguardo a questo ritrovamento si può consultare il recente articolo in versione bilingue inglese e italiana: LEZZI, T. & GALEOTTI, G., 2022. Description of two Italian records ofSquamanita schreieri. RMR, Boll. Amer 115, Anno XXXVIII, 2022 (1): 31-38. [Data di accesso: 10/01/2023]. LEZZI, T. & GALEOTTI, G., 2022. Descrizione di due ritrovamenti in Italia di Squamanita schreieri. RMR, Boll. Amer 115, Anno XXXVIII, 2022 (1): 31-38. [Data di accesso: 10/01/2023]. All'interno dell'articolo sono disponibili la descrizione dettagliata del ritrovamento, e una discussione più approfondita. Bibliografia LEZZI, T. & GALEOTTI, G., 2022. Description of two Italian records ofSquamanita schreieri. RMR, Boll. Amer 115, Anno XXXVIII, 2022 (1): 31-38. [Data di accesso: 10/01/2023]. LEZZI, T. & GALEOTTI, G., 2022. Descrizione di due ritrovamenti in Italia di Squamanita schreieri. RMR, Boll. Amer 115, Anno XXXVIII, 2022 (1): 31-38. [Data di accesso: 10/01/2023]. LIU, J.-W., GE, Z.-W., HORAK, E., VIZZINI, A., HALLING, R.E., PAN, C.-L. & YANG, Z.-L., 2021. Squamanitaceae and three new species of Squamanita parasitic on Amanita. IMA Fungus 12: 4. https://doi.org/10.1186/s43008-021-00057-z [Data di accesso: 29/01/2020]. SCHREIER, L., 1938 Tricholoma X. Schweizerischen Zeitschrift für Pilzkunde 7: 97-100. VIZZINI, A. & GIRLANDA, M., 1997. Squamanita umbonata (Sumst.) Bas, a mycoparasite of Inocybe oblectabilis (Britz.) Sacc. Allionia 35: 171-175. VIZZINI, A., 2014. Index Fungorum 166. Scheda di proprietà AMINT realizzata da Giovanni Galeotti e Tomaso Lezzi - Approvata e Revisionata dal CLR Micologico di AMINT. Regione Umbria; Settembre 2020; Foto di Giovanni Galeotti. Ritrovamento effettuato in bosco misto: su terreno marnoso arenaceo: Quercus pubescens Willd., Quercus ilex L., Cedrus atlantica (Endl.) Manetti ex Carrière e Pinus nigra J.F. Arnold. Pochi giorni prima del ritrovamento, nonché durante i giorni del ritrovamento sono stati osservati nei pressi esemplari di Amanita strobiliformis che confermano l'ipotesi del parassitismo di Squamanita schreieri su Amanita strobiliformis. Trama lamellare. Osservazione in rosso Congo, a 100×. Trama lamellare. Osservazione in rosso Congo, a 400×. Trama lamellare. Osservazione in rosso Congo, a 400×. Trama lamellare. Osservazione in rosso Congo, a 400×. Pileipellis. Osservazione in rosso Congo, a 400×. Pileipellis. Osservazione in acqua, a 1000×. Pileipellis, ìfe oleifere della cuticola. Osservazione in acqua, a 1000×. Pileipellis, GAF. Osservazione in acqua, a 1000×. Clamidospore. Osservazione in acqua, a 400×. Clamidospore. Osservazione in acqua, a 1000×. Clamidospore. Osservazione in acqua, a 1000×. Basidi clavati tetrasporici. Osservazione in rosso Congo, a 400×. Basidi clavati tetrasporici. Osservazione in rosso Congo, a 1000×. . Ife del bulbo. Osservazione in rosso Congo, a 400×. Ife del bulbo. Osservazione in rosso Congo, a 400×. Ife del bulbo. Osservazione in rosso Congo, a 1000×. Spore(4,6) 4,8-6,5 (7,6) × (3,4) 3,7-4,8 (5,4) μm; Q = (1,0) 1,2-1,6 (1,7); N = 52; Media = 5,8 × 4,2 μm; Qm = 1,4. Osservazione in acqua, a 1000×. Spore.Osservazione in rosso Congo, a 1000×. -
Inocybe tenebrosa Quél. 1885 Tassonomia Divisione Basidiomycota Classe Agaricomycetes Ordine Agaricales Famiglia Inocybaceae Genere Inocybe Sottogenere Inocybe Sezione Splendentes Sinonimi Inocybe atripes G.F. Atk. 1918 Etimologia L'epiteto Inocybe deriva dal greco ἴς/ἴνος [is/inos] = fibra e "κύβη" [cýbe] = testa, per il cappello spesso tomentoso o dissociato in fibre. L'epiteto tenebrosa deriva dal latino tenebrosus, a, um = tenebroso, per l'annerimento alla base del gambo. Cappello Cappello di dimensione fino a circa 4-5 cm, di forma non perfettamente circolare, irregolare, la superficie da giovane è liscia, finemente fibrillosa, poi dissociata in squame di colore ocra, marrone uniforme nei soggetti giovani, ma in vecchiaia assume colorazioni a chiazze più brune, con ciuffi di squamette più scuri su uno sfondo più chiaro, bordo del cappello più chiaro ad andamento lobato con cuticola eccedente. Imenoforo Lamelle smarginate, biancastre da giovani, poi ocra-olivastre, con più ordini di lamellule. Gambo Gambo cilindrico, a volte contorto, fibrilloso, pruinoso, con base più larga, dalla base fino al centro di colore bruno-nerastro, grigiastro con sfumature olivastre, e biancastro fino all’apice del gambo. Il colore nero antracite è sempre presente alla base del gambo, da questo carattere trae origina l'epiteto specifico, che contrasta in modo molto evidente con il bianco candido della parte superiore del gambo. Carne Bianca. Odore spermatico complesso, ma anche con nota di odore banana. Habitat Cresce in boschi misti, giardini, parchi pubblici, con alberi decidui, spesso sotto querce e lecci, su suolo calcareo, fungo simbionte, dall'inizio dell'estate al tardo autunno, in gruppi numerosi, gregario o anche con i gambi appressati. Microscopia Spore (7,9) 8,2-9,9 (10,1) × (5,1) 5,2-6,3 µm; Q = (1,3) 1,4-1,8 (1,9); Media = 9,1 × 5,7 µm; Qm = 1,6; subamigdaliformi, lisce, a volte con guttula centrale. Basidi clavati, tetrasporici. Cheilocistidi cilindrico-clavati, clavati, fusiformi, metuloidi (a parete spessa) e muricati (con cristalli all’apice), multisettati, osservati fino a 3 setti. In questi ultimi la parete assume in KOH 5% una evidente colorazione gialla, ad alta rifrangenza. Pleurocistidi simili ai cheilocistidi. Caulipellis formata da Ife parallele, prevalentemente cilindriche, con abbondanti giunti a fibbia. Caulocistidi presenti su tutto il gambo, di diversa morfologia, spesso riuniti a ciuffetti, nella parte alta e fino a metà gambo cilindrici e clavati, metuloidi (a parete spessa) e alcuni muricati (con cristalli all’apice), nel terzo inferiore a fino alla base del gambo cilindrico-clavati a parete sottile. GAF a medaglione presenti nelle ife della trama lamellare. Commestibilità e tossicità Si ritiene velenosa come tutte le Inocybe, con sindrome muscarinica. Per approfondimenti consulta la Pagina di Micotossicologia. Specie simili Inocybe brunneotomentosa Huijsman, è forse la specie più simile, avendo gambo e cistidi simili. Si differenzia per i cistidi più corti e per il gambo ricoperto solo da caulocistidi metuloidi localizzati esclusivamente nel primo terzo superiore. Bibliografia AA.VV., 2018. Funga Nordica. Agaricoid, boletoid and cyphelloid genera. Ed. Nordsvamp. 2nd Edition, 2nd printing. Scheda di proprietà AMINT realizzata da Mario Iannotti e Giovanni Galeotti - Approvata e Revisionata dal CLR Micologico di AMINT. Regione Umbria; Gennaio 2023; Foto e microscopia di Mario Iannotti. Ritrovamento effettuato in un parco pubblico nei pressi di Quercus ilex L. Spore (7,9) 8,2-9,9 (10,1) × (5,1) 5,2-6,3 µm; Q = (1,3) 1,4-1,8 (1,9); Media = 9,1 × 5,7 µm; Qm = 1,6, subamigdaliformi, lisce, a volte con guttula centrale. Osservazione in KOH 5%, a 1000×. Basidi clavati, tetrasporici. Osservazione in rosso Congo, a 1000×. Cheilocistidi cilindrico-clavati, clavati, fusiformi, metuloidi con cristalli all’apice, multisettati, osservati fino a 3 setti. In questi ultimi la parete assume in KOH 5% una evidente colorazione gialla, ad alta rifrangenza. Osservazione in KOH 5%, a 400×. Osservazione in KOH 5%, a 1000×. Pleurocistidi simili ai cheilocistidi. Osservazione in rosso Congo, a 400×. Osservazione in rosso Congo, a 1000×. Caulocistidi presenti su tutto il gambo, di diversa morfologia, spesso riuniti a ciuffetti, nella parte alta e fino a metà gambo cilindrici e clavati, metuloidi (a parete spessa) e alcuni muricati (con cristalli all’apice), nel terzo inferiore a fino alla base del gambo cilindrico-clavati a parete sottile. Osservazione in rosso Congo, a 400×. Terzo inferiore, caulocistidi cilindrico-clavati a parete sottile. Osservazione in rosso Congo, a 400×. GAF a medaglione nelle ife della lamella. Osservazione in rosso Congo, a 1000×. Regione Umbria; Gennaio 2023; Foto e microscopia di Giovanni Galeotti. Ritrovamento effettuato in un parco pubblico nei pressi di Quercus ilex L. Spore (7,4) 8,2-9,8 (10,5) × (0,9) 5,3-6,2 (6,5) µm; Q = (1,4) 1,5-1,8 (1,9); N = 48; Media = 9,2 × 5,7 µm; Qm = 1,6; Osservazione in acqua, a 1000×. Basidi clavati tetrasporici. Osservazione in rosso Congo, a 1000×. Cheilocistidi. Osservazione in rosso Congo, a 400×. Osservazione in rosso Congo, a 1000×. Caulipellis formata da Ife parallele, prevalentemente cilindriche, con abbondanti giunti a fibbia. Osservazione in rosso Congo, a 400×. Caulocistidi. Osservazione in rosso Congo, a 400×.
-

Amanita excelsa var. spissa (Fr.) Neville & Poumarat 2004
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Commestibili
Amanita excelsa var. spissa (Fr.) Neville & Poumarat; Regione Marche; Giugno 2022; Foto di Mario Iannotti. -

Polyporus squamosus (Huds. : Fr.) Fr. 1821
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Polyporus squamosus (Huds. : Fr.) Fr.; Regione Marche; Maggio 2022; Foto di Pietro Curti. Imenoforo e pileo. Imenoforo e pileo. -

Calvatia utriformis (Bull. : Pers.) Jaap 1918
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Commestibili
Calvatia utriformis (Bull. : Pers.) Jaap; Regione Marche, Monte Nerone; Maggio 2022; Foto di Mario Iannotti. -

Suillellus luridus (Schaeff. : Fr.) Murrill 1909
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Commestibili
Suillellus luridus (Schaeff. : Fr.) Murrill; Regione Marche; Giugno 2022; Foto e commento di Mario Iannotti. Lo stesso esemplare con un imbrunimento evidente dopo essere stato manipolato. La "linea di Bataille", cioè una superficie rosso carnicino che si trova nella carne al di sopra dei tubuli. -

Thaxterogaster barbatus s.l. (Batsch) Niskanen & Liimat. : Fr. 2022
Archivio Micologico ha postato un topic nell'area Funghi Non Commestibili o Sospetti
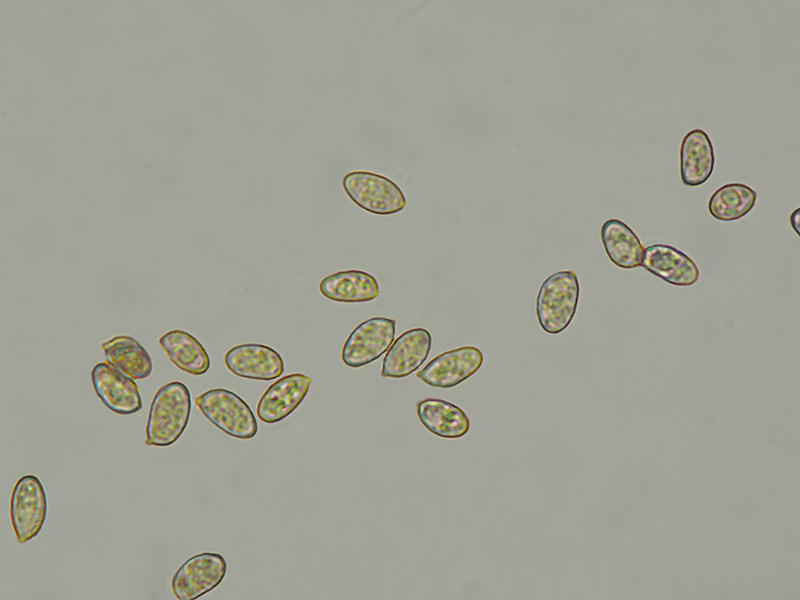
Thaxterogaster barbatus s.l. (Batsch) Niskanen & Liimat. : Fr. 2022 Tassonomia Divisione Basidiomycota Classe Agaricomycetes Ordine Agaricales Famiglia Cortinariaceae Genere Thaxterogaster Sottogenere Myxacium (Il sottogenere Myxacium appartiene al genere Cortinarius da cui sono stati separati alcuni Thaxterogaster. Manteniamo qui anche questa suddivisione per aiutare il lettore ad orientarsi nella sistematica) Sezione Vibratiles (la sezione Vibratiles appartiene al genere Cortinarius da cui sono stati separati alcuni Thaxterogaster. Manteniamo qui anche questa suddivisione per aiutare il lettore ad orientarsi nella sistematica) Premessa La posizione sistematica di questa specie non è ancora chiara, e sono diverse le interpretazioni dei vari autori per questa specie, così come dei suoi sinonimi, nonché delle specie simili. Per questo momento la scheda descrittiva viene titolata come "Thaxterogaster barbatus s.l.", dal latino sensu lato = in senso lato, esteso. In attesa di nuovi studi che possano fare maggiore chiarezza su questo gruppo di specie. Sinonimi Cortinarius crystallinus Fr. 1838 Myxacium barbatum (Batsch) P. Kumm. 1871 Cortinarius barbatus (Batsch) Melot 1989 Etimologia L'epiteto Thaxterogaster deriva dal nome proprio del Micologo Rholand Taxter a cui è stato dedicato il genere da Singer e dal termine greco γαστήρ (gastér) = ventre, stomaco. L'epiteto barbatus deriva dal latino barba -ae = barba. Cappello 2-5 cm, sfumato dal bianco all'ocra. Dapprima emisferico, poi convesso, espanso, con margine ondulato e andamento del cappello irregolare. Sapore della cuticola decisamente amaro. Imenoforo Lamelle smarginate, bianco ocracee, poi ocra giallastro per il colore della sporata. Sono presenti lamellule di vario ordine. Gambo Cilindrico, bianco, con presenza di una cortina araneosa fugace. Sapore amaro, come la cuticola. Carne Biancastra, sia nel cappello che nel gambo, con odore forte, complesso, aromatico, ma sgradevole. Sapore amaro, come la cuticola. Reazioni macrochimiche Fondamentalmente neutre con KOH 30% su cappello, gambo e carne. Habitat Latifoglie, in particolare con Quercus spp. Microscopia Spore (5,7) 7,0-8,1 (9,0) × (3,7) 4,0-4,5 (5,0) µm; Q = (1,4) 1,6-1,9 (2,2); N = 57; Media = 7,6 × 4,3 µm; Qm = 1,8; ellissoidali in vista frontale, amigdaliformi in vista laterale, con verruche sottili. Commestibilità e tossicità Non commestibile. Specie simili Thaxterogaster emollitoides (Bidaud, Moënne-Locc. & Reumaux) Niskanen & Liimat. = Cortinarius emollitoides Bidaud, Moënne-Locc. & Reumaux = Cortinarius galeobdolon Melot sensu auct. si distinguerebbe per il sapore amaro solo nel cappello e per l'habitat di aghifoglia. Thaxterogaster causticus (Fr.) Niskanen & Liimat. = Cortinarius causticus Fr. sarebbe sempre specie di aghifoglia. Thaxterogaster alboamarescens (Kytöv., Niskanen & Liimat.) Niskanen & Liimat. = Cortinarius alboamarescens Kytöv., Niskanen & Liimat. si distingue per le spore più piccole e subglobose. Bibliografia AA.VV., 2018. Funga Nordica. Agaricoid, boletoid and cyphelloid genera. Ed. Nordsvamp. 2nd Edition, 2nd printing. CALLEDDA F., CAMPO E., FLORIANI M. & MAZZA R. 2021. Guida Introduttiva al genere Cortinarius in Europa. Ed. Osiride. Scheda di proprietà AMINT realizzata da Tomaso Lezzi e Luigi Minciarelli - Approvata e Revisionata dal CLR Micologico di AMINT. Regione Umbria; Gennaio 2023; Foto e microscopia di Tomaso Lezzi. Campioni rinvenuti il giorno di capodanno 2023 durante un escursione con Luigi Minciarelli in un bosco termofilo di Quercus ilex, Quercus cerris e sottobosco con Arbutus unedo. Spore (5,7) 7,0-8,1 (9,0) × (3,7) 4,0-4,5 (5,0) µm; Q = (1,4) 1,6-1,9 (2,2); N = 57; Media = 7,6 × 4,3 µm; Qm = 1,8; ellissoidali in vista frontale, amigdaliformi in vista laterale, con verruche sottili.-
- cortinarius barbatus
- cortinarius crystallinus
- (e 2 in più)
-

Entoloma sericeoides (J.Lange) Noordeloos 1980
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Entoloma sericeoides (J.E. Lange) Noordel.; Regione Lombardia; Aprile 2016; Foto e microscopia di Massimo Biraghi. Cappello lucido nei giovani esemplari e di colore bruno chiaro, cervo, tendente al bruno cupo negli esemplari più maturi, con riflessi doroati, opachi, il margine è spesso lobato, con fibrille radiali che non raggiungono il centro ombelicato. Lamelle decorrenti, sinuose, mediamente fitte e con presenza di lamellule, di colore grigio-brunastro poi progressivamente tinte di rosa, filo eroso. Gambo compresso e schiacciato, carattere tipico di molte specie del genere Entoloma, cavo, leggermente più chiaro del pileo, con evidenti striature longitudinali, biancastro alla base, anche vicino all'attacco con l'imenio nei giovani esemplari. Carne bruno chiara nella zona subcuticolare e corticale del gambo, più chiara altrove, odore erbaceo, distintamente farinoso allo sfregamento del basidioma, sapore di farina rancida. Specie con crescita esclusivamente primaverile sotto Rosaceae in terreno argilloso-sabbioso. Spore quasi isodiametriche: (7)8-9(9,5)×6-7,5 µm; misure medie: 8,48×6,69 µm; Q=1,28. Basidi tetrasporici e bisporici 30-38×10-15 µm; sterigmi che non arrivano a 3 µm. GAF non osservati. Pileipellis con ife incrostate. Altri Entoloma con crescita tipicamente primaverile sotto Rosaceae sono: Entoloma clypeatum, di dimensioni maggiori e con crescita in grandi gruppi che formano spesso "cerchi delle streghe", con colorazione pileica bruno chiaro con riflessi grigio-olivastri e esemplari con crescita spesso fascicolata. Entoloma hirtipes ha colorazioni pileiche più scure, cappello evidentemente conico con distinto umbone ottuso e crescita sotto conifere montane o Fagaceae, microscopicamente si differenzia per la presenza di giunti a fibbia abbondanti in tutti tessuti. Entoloma sericeum ha crescita prevalentemente autunnale, cappello mai ombelicato, crescita tendenzialmente praticola, microscopicamente si differenza per la presenza di giunti a fibbia nella trama imeniale e alla base dei basidi. Spore quasi isodiametriche: (7)8-9(9,5)×6-7,5 µm; misure medie: 8,48×6,69 µm; Q=1,28. Basidi tetrasporici e bisporici 30-38×10-15 µm; sterigmi che non arrivano a 3 µm. -

Entoloma sericeoides (J.Lange) Noordeloos 1980
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Entoloma sericeoides (J.E. Lange) Noordel.; Regione Umbria; Aprile 2022; Foto di Mario Iannotti. -

Entoloma sericeoides (J.Lange) Noordeloos 1980
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Entoloma sericeoides (J.E. Lange) Noordel.; Regione Umbria; Aprile 2022; Foto di Pietro Curti. -

Fomitopsis pinicola (Sw. : Fr.) P. Karst. 1881
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Fomitopsis pinicola (Sw. : Fr.) P. Karst.; Regione Molise, Bosco di Montecastelbarone (IS); Maggio 2022; Foto di Enzo Orgera. -

Discina gigas (Krombh.) Eckblad 1968
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Velenosi
Discina gigas (Krombh.) Eckblad; Regione Molise, Bosco di Montecastelbarone (IS); Maggio 2022; Foto di Enzo Orgera.- 13 risposte
-
- discina gigas
- falsa spugnola
-
(e 2 in più)
Tag usato:
-

Entoloma hirtipes (Schumach.) M.M. Moser 1978
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Entoloma hirtipes (Schumac. : Fr.) MM Moser; Regione Molise, Bosco di Montecastelbarone (IS); Maggio 2022; Foto di Enzo Orgera. Microscopia di Antonio Albanese. Pileipellis costituita da ife cilindriche con pigmento incrostante e intracellulare bruno-giallastro. Spore eterodiametriche, poligonali, misura :(9,2) 10 - 12,7 (13,1) × (7,5) 7,9 - 9,5 (10,2) µm; Q = (1,1) 1,2 - 1,4 (1,5) ; N = 30; Media = 11,5 × 8,8 µm ; Qm = 1,3. Basidi tetrasporici. Cheilocistidi sublageniformi e a volte subcapitulati. -

Xerocomus silwoodensis A.E. Hills, U. Eberhardt & A.F.S. Taylor, 2007
Archivio Micologico ha postato un topic nell'area Funghi Commestibili
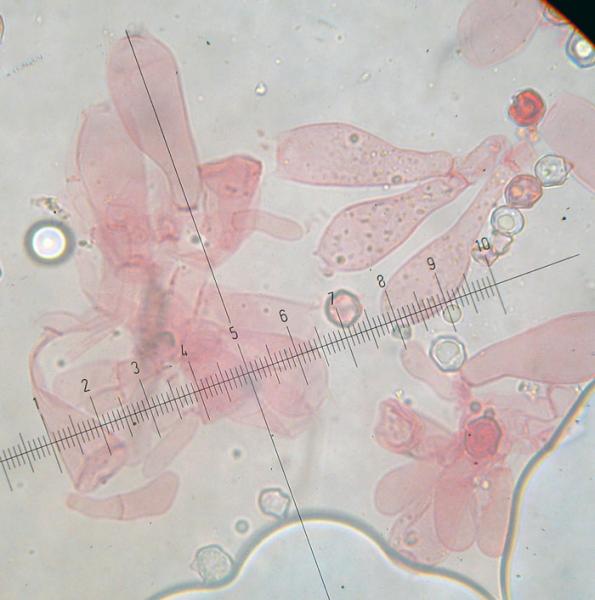
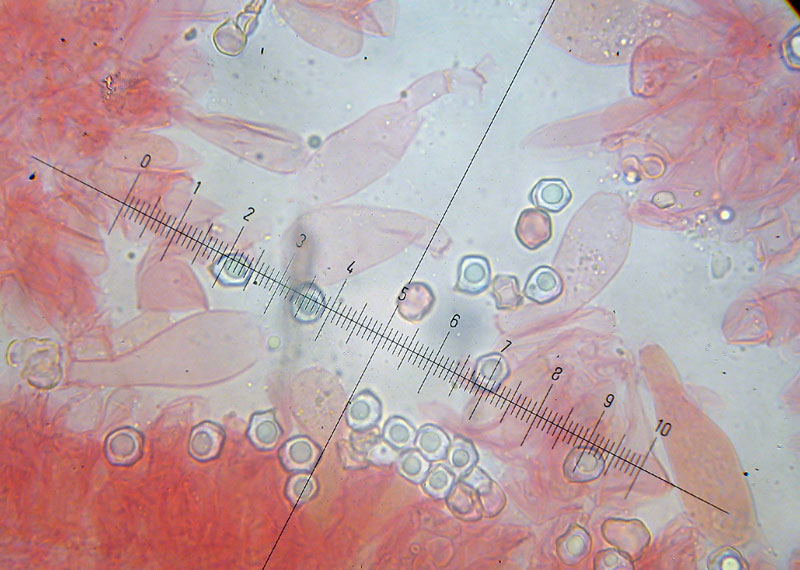
Xerocomus silwoodensis A.E. Hills, U. Eberhardt & A.F.S. Taylor, 2007 Tassonomia Divisione Basidiomycota Classe Agricomycetes Ordine Boletales Famiglia Boletaceae Etimologia L'epiteto Xerocomus deriva dal greco ξηρός [xerós] = arido e da κόμη [kóme] = chioma, per il cappelo asciutto. L'epiteto silwoodensis deriva dal luogo del primo ritrovamento: Silwood Park (Berkshire, UK). Cappello 25-60 (80) mm, inizialmente emisferico, da convesso a piano convesso, pulvinato, di colore bruno aranciato, laterizio con leggere tonalità rosate, fino a marrone scuro, più pallido verso il margine; cuticola asciutta, opaca, da tomentosa a finemente vellutata, non fessurata; margine sottile, dapprima involuto poi ricurvo verso il basso, talvolta debolmente lobato e ondulato, leggermente eccedente oltre i tubuli. Pori Superficie leggermente concava, con pori dapprima labirintici ma presto più ampi, angolosi, poligonali, concolori ai tubuli ma con tenui toni rosato-aranciati, permangono di forma irregolare, a labirinto nei pressi del margine e via via sono sempre più ampi verso il gambo, dove diventano arrotondati, con macchie aranciato-rugginose nelle zone contuse e/o manipolate. Tubuli Dapprima abbastanza stretti e sottili, poi gradualmente più larghi, più corti dello spessore della carne del cappello, depressi intorno all'apice e decorrenti per un breve tratto lungo il gambo, di colore giallo intenso, immutabile al taglio. Gambo 25-70 (120) × 10-20 (25) mm, generalmente più o meno sinuoso, ingrossato all'apice tende ad essere affusolato alla base, di colore bianco-giallastro, giallo-aranciato pallido, più chiaro rispetto alla colorazione pileica, con evidenti costolature rilevate di colore rosso-ruggine, formanti un reticolo grossolano ed irregolare costituito da maglie allungate più o meno complete, distribuite lungo tutta la superficie, più marcate nei due terzi superiori. Quando il reticolo è confinato nella parte apicale del gambo, come si può notare in uno degli esemplari qui descritti, le costolature, mano a mano che scendono verso il basso, si dissolvono in una fine punteggiatura aranciata, che ricopre buona parte della superficie dello stipite fin quasi all'estrema base, la quale è ricoperta da tomentosità biancastra, con evidente micelio basale sempre di colore giallo. Carne Soda, consistente, giallastra nel cappello, tendente progressivamente ad assumere tonalità più intense fino al giallo cromo, a seguito di esposizione all’aria e durante il processo di disidratazione/essiccazione, biancastra nel gambo, ma giallo pallida lungo il perimetro corticale; immutabile al taglio; odore non significativo, indistinto; sapore mite, delicato. Habitat X. silwoodensis ha un rapporto di tipo simbiontico con diverse essenze arboree, ma in particolar modo ama stringere uno stretto legame con Populus spp. Gli esemplari descritti, sono stati rinvenuti in un bosco planiziale, ad un'altitudine che oscilla circa dai 300 ai 400 metri s.l.m. L'ambiente boschivo in questione, è punteggiato da abbondanti Pioppi bianchi (Populus alba L.), anche se è costituito come specie dominanti da Querce caducifoglie, (Quercus cerris L.), con presenza di altre essenze quali Carpino nero (Ostrya carpinifolia Scop.), Nocciolo (Corylus avellana L.) e altre specie arbustive. Commestibilità e tossicità Commestibile, ma specie da preservare per la sua rarità. Microscopia Nella stessa area boschiva sono stati effettuati due ritrovamenti, il primo nell'anno 2021 ed il secondo a distanza di un anno nel mese di agosto 2022. Primo ritrovamento (exsiccatum GG211005-01), microscopia di Giovanni Galeotti. Spore (9,6) 10,1-11,9 (12,3) × (3,9) 4,4-5,1 (5,2) µm; Q = (2,0) 2,2-2,5 (2,6); N = 50; Media = 11,0 × 4,7 µm; Qm = 2,3; da largamente ellittiche a ellittico fusiformi in vista laterale, ellittiche in vista frontale, parete liscia, da sottile a moderatamente spessa, apicolo evidente non molto pronunciato, con depressione più o meno accennata nella zona soprailare. Basidi in prevalenza tetrasporici, scarsi bisporici o monosporici, da cilindrico-clavati a decisamente clavati con presenza di lunghi sterigmi. Cheilocistidi fusiformi e clavati, con pareti spesse e apice arrotondato. Pleurocistidi simili ai cheilocistidi. GAF non osservati. Pileipellis di tipo tricoderma, formata da ife allungate, cilindriche, settate e catenulate, con apici arrotondati. Stipitipellis formata da ife sottili, parallele, cilindriche e ricurve, con margini arrotondati. Caulobasidi e Caulocistidi la parte apicale dello stipite è rivestita da uno strato imeniale fertile, si osservano caulobasidi tetrasporici e caulocistidi simili a quelli osservati nell'imenoforo. Secondo ritrovamento (exsiccatum MI220828-01), microscopia di Mario Iannotti. Spore (10,2) 10,3-12,9 (13,2) × (3,9) 4,1-5,0 µm; Q = 2,3-2,8; N = 32; Media = 11,7 × 4,5 µm ; Qm = 2,6; cilindrico-fusiformi, apicolo evidente, con presenza di piccole guttule e netta depressione nella zona soprailare. Basidi tetrasporici, clavati. Cheilocistidi 42,1-58,3 × 9,0-12,4 µm, simili ai pleurocistidi, ma anche cilindrico-claviformi. Pleurocistidi 44,6-57,0 × 9,1-14,4 µm, fusiformi, lisci ed a parete sottile. GAF non osservati. Pileipellis formata da un tricoderma di ife più o meno erette, 10,7-15,3 µm di diametro, poco intrecciate, con cellule terminali arrotondate. Specie simili X. chrysonemus A.E. Hills & A.F.S. Taylor, cappello di colore variabile, con tonalità che vanno da grigio-giallo a senape e bruno-olivastro. Come X. silwoodensis a volte presenta, limitatamente al terzo superiore del gambo, uno pseudoreticolo bruno rossiccio, più o meno accennato, a maglie allungate e irregolari, che diventa meno marcato nei due terzi inferiori e si trasforma in areole sempre più sottili, fino a divenire una finissima punteggiatura con i medesimi cromatismi; alla sezione mostra carne di colore giallastro nel pileo, progressivamente più intenso verso il basso, da giallo senape a giallo brillante alla base (LEZZI et al., 2021), soprattutto negli esemplari giovani, carne immutabile quando esposta all'aria. Micelio basale giallo dorato. Fruttifica associato ad alberi decidui, principalmente Quercus spp. Le principali differenze tra X. chrysonemus e X. silwoodensis riguardano la diversa colorazione del pileo, che in X. silwoodensis si presenta con tonalità più rosso-brune, rosso-rugginose fino a marrone scuro, un gambo con base attenuata, profondamente infissa nel substrato e lo stretto legame con essenze arboree del genere Populus, differentemente da X. chrysonemus che predilige boschi termofili di latifoglie con presenza dominante di Quercus spp. X. ferrugineus (Schaeff.) Alessio e X. subtomentosus (L.) Quél. sono le due specie di Xerocomus più comuni e diffuse in Italia, la prima presente nei boschi di montagna per lo più associata a Picea abies e Fagus sylvatica, la seconda che cresce in zone più calde, sotto latifoglie come Castanea sativa Mill., Corylus avelana e Quercus spp., in ambiente anche mediterraneo. X. subtomentosus, con colorazione pileica molto variabile, spazia dal giallo, al verde, al rosso, passando attraverso i toni che variano dall'ocra al bruno; alla sezione presenta carne da giallo pallida a giallo vivace, con debole e lento viraggio all’azzurro, soprattutto sopra i tubuli e all’inserzione tra gambo e cappello, e mostra colorazioni rosato incarnate nella parte inferiore del gambo. Micelio basale biancastro. Legato a boschi caldi e aperti di latifoglia, fruttifica ad altitudini inferiori rispetto a X. ferrugineus. X. silwoodensis si distingue da X. subtomentosus per la differente reazione della carne in sezione, infatti in X. silwoodensis non vi è alcun accenno di viraggio all'azzurrognolo verdastro, la colorazione della carne è inizialmente biancastra, poi rapidamente giallastra, con assenza della caratteristica colorazione rosata o brunastra alla base del gambo; diversamente la carne in sezione in X. subtomentosus, a contatto con l’aria, tende debolmente verso tonalità azzurro-verdastre, principalmente nella zona di inserzione tra gambo e cappello e nei pressi dei tubuli, mentre nella porzione basale assume toni rosato-incarnati. X. ferrugineus, ha colorazioni del cappello molto variabili, da giallo-verdastro a olivastro-giallastro, bruno-olivastro, bruno, bruno-rossastro, bruno scuro; alla sezione mostra carne di colorazione quasi bianca, a volte con delle sfumature giallastre alla estrema base del gambo, nella zona in cui è presente il micelio. Assenza di viraggio alla sezione. Micelio basale da giallo a giallo vivace; specie legata ad ambienti più temperati (sub)montani. Tra le specie affini X. ferrugineus è la specie che predilige fruttificare ad altitudini maggiori. Aureoboletus moravicus (Vacek) Klofac va inoltre citato per la sua somiglianza, anche se non appartiene al genere Xerocomus s.s.; Il portamento xerocomoide, l'aspetto tomentoso e asciutto della cuticola, la colorazione pileica e non per ultimo l'assenza di viraggio della carne alla sezione, fanno sì che A. moravicus sia morfologicamente molto vicino a X. silwoodensis. Le due specie rimangono comunque distinte a livello macromorfologico per l'assenza del grossolano reticolo aranciato, presente nel tratto superiore del gambo di X. silwoodensis, per la cuticola che negli esemplari maturi di A. moravicus tende gradualmente a fessurarsi in minute areolature, per la carne non giallastra, ma biancastra alla sezione e per l'odore che in A. moravicus risulta essere dolciastro, fruttato, intenso e molto gradevole. Note nomenclaturali La specie X. silwoodensis è stata istituita nel 2007 (TAYLOR et al. 2006). Come riportato da LEZZI et al., (2021) il genere Xerocomus Quél. ha subito negli ultimi anni un notevole sconvolgimento basato sull'indagine morfologica e sugli studi molecolari effettuati da BINDER & HIBBERT (2006); EBERHARDT & TAYLOR (2005); BAKKER & NOORDELOOS (2005) e ŠUTARA (2008). In particolare, diversi nuovi generi sono stati segregati da Xerocomus come delimitato tradizionalmente (vale a dire Hemileccinum, Hortiboletus, Imleria, Pseudoboletus, Rheubarbariboletus, Xerocomus s.s. e Xerocomellus s.s.), oppure alcune specie sono state trasferite a generi preesistenti (Phylloporus e Aureoboletus), vedi TAYLOR et al. (2006); ŠUTARA (2008); BINDER & HIBBERT (2006); KLOFAC (2010). Attualmente il genere Xerocomus s.s. comprende quattro specie europee: X. chrysonemus, Xerocomus ferrugineus, X. subtomentosus e X. silwoodensis. Il genere è caratterizzato da pileipellis a tricoderma, con cellule terminali prive di incrostazioni, spore bacillate al SEM e trama dell'imenoforo divergente bilaterale di “tipo Phylloporus” (REDEUILH 1994; TAYLOR et al. 2001; TAYLOR et al. 2002, LADURNER & SIMONINI 2003; GELARDI 2011; SIMONINI et al. 2016; LEZZI et al., 2021). Ringraziamenti Si ringraziano Francesca Barchiesi per la tavola ad acquarello, Giancarlo Angeles per aver curato l'analisi filogenetica del campione GG211005-01, che verrà pubblicata a breve in un articolo dettagliato e Giulio Savatonio sia per il ritrovamento dell'esemplare GG211005-01 che per la descrizione dell'habitat di rinvenimento dello stesso. Bibliografia citata BAKKER H.C. & NOORDELOOS M.E., 2005. A revision of European species of Leccinum Gray and notes on extralimital species. Persoonia 18: 511-587. BINDER M. & HIBBERT D.S., 2006. Molecular systematic and biological diversification of Boletales. Mycologia 98 (6): 971-981. EBERHARDT U. & TAYLOR A.F.S., 2005. Molecular systematics of boletoid fungi. In Muñoz J.A., Boletus s. l. Fungi Europæi 2: 35-43. GELARDI M., 2011. A noteworthy british collection of Xerocomus silwoodensis and a comparative overview on the european species of X. subtomentosus complex. Boll. AMER 84, XXVII, 2011 (3): 28-38. KLOFAC W., 2010. The genus Aureoboletus, a world-wide survey. A contribution to a monographic treatment. Österr. Z. Pilzk. 19: 133-174. LADURNER, H. & SIMONINI G., 2003. Xerocomus s.l. Fungi Europæi. Vol. 8 Ed. Candusso. LEZZI L., GENNARI A. & IANNOTTI M., 2021. Descrizione del primo ritrovamento in Italia di Xerocomus chrysonemus. RMR, Boll. AMER 114, XXXVII, 2021 (3): 145-153. REDEUILH G., 1994. La reazione ammoniacale nei Boleti del gruppo subtomentosus. Atti delle 2e giornate C.E.M.M., Oliena: 35-44. SIMONINI G., GELARDI M. & VIZZINI A., 2016. Xerocomellus redeuilhii sp. nov. RdM 59 (2): 123-127. ŠUTARA J., 2008. Xerocomus s. l. in the light of the present state of knowledge. Czech Mycol. 60 (1): 29-62. TAYLOR A.F.S., JONSSON L., JONSSON M., ROSLING A., HILLS A.E. & SIMONINI G., 2001. Species delineation within European species of Xerocomus using Internal Transcriber Spacer sequence data. Micol. e Veget. Medit. 16 (2): 171-192. TAYLOR A.F.S., HILLS A.E. & SIMONINI G., 2002. A fresh look at European Xerocomoid fungi. Field Mycol. 3 (3): 89-102. TAYLOR A.F.S., HILLS A.E., SiIMONINI G., BOTH E.E. & EBERHARDT U., 2006. Detection of species within the Xerocomus subtomentosus complex in Europe using rDNA-ITS sequences. Mycol. Res. 110: 276-287. TAYLOR A.F.S., HILLS A.E., SIMONINI G., MUNOZ J.A. & EBERHARDT U., 2007. Xerocomus silwoodensis sp. nov., a new species within the European X. subtomentosus complex. Mycological research III :403-408. Scheda di proprietà AMINT realizzata da Giovanni Galeotti, Alessandro Gigli e Mario Iannotti - Revisionata da Tomaso Lezzi, approvata dal CLR Micologico di AMINT. Regione Umbria; Ottobre 2021; Legit Giulio Savantonio, Foto e microscopia di Giovanni Galeotti. (exsiccatum GG211005-01) Soggetti rinvenuti durante un'uscita didattica del 12° corso di formazione per Micologi, organizzato dalla Scuola di Amministrazione Pubblica di Villa Umbra (PG). Particolare dello stipite che mette in evidenza le costolature rosse in rilievo, e la base assottigliata. Pileipellis. Osservazione in rosso Congo, a 400×. Pileipellis. Osservazione in rosso Congo, a 400×. Pileipellis. Osservazione in rosso Congo, a 400×. Cheilocistidi. Osservazione in rosso Congo, a 400×. Cheilocistidi. Osservazione in rosso Congo, a 400×. Cheilocistidi. Osservazione in rosso Congo, a 400×. Caulobasidi e Caulocistidi sulla parte alta dello stipite. Osservazione in rosso Congo, a 400×. Caulocistidi sulla parte alta dello stipite. Osservazione in rosso Congo, a 400×. Caulipellis. Osservazione in rosso Congo, a 400×. Pleurocistidi e Basidi. Osservazione in rosso Congo, a 400×. Pleurocistidi e Basidi. Osservazione in rosso Congo, a 400×. Spore. Osservazione in rosso Congo, a 400×. Spore (9,6) 10,1-11,9 (12,3) × (3,9) 4,4-5,1 (5,2) µm; Q = (2,0) 2,2-2,5 (2,6); N = 50; Media = 11,0 × 4,7 µm; Qm = 2,3; Osservazione in rosso Congo, a 1000×. Regione Umbria; Agosto 2022; Foto e microscopia di Mario Iannotti. (exsiccatum MI220828-01) Spore (10,2) 10,3-12,9 (13,2) × (3,9) 4,1-5,0 µm; Q = 2,3-2,8; N = 32; Media = 11,7 × 4,5 µm ; Qm = 2,6; cilindrico-fusiformi, apicolo evidente, con presenza di piccole guttule e netta depressione nella zona soprailare. Osservazione in rosso Congo ammoniacale, a 1000×. Basidi tetrasporici, clavati. Osservazione in rosso Congo ammoniacale, a 1000×. Cheilocistidi 42,1-58,3 × 9,0-12,4 µm, simili ai pleurocistidi, ma anche cilindrico-claviformi. Osservazione in rosso Congo ammoniacale, a 1000×. Pleurocistidi 44,6-57,0 × 9,1-14,4 µm, fusiformi, lisci ed a parete sottile. Osservazione in rosso Congo ammoniacale, a 1000×. Pileipellis formata da un tricoderma di ife più o meno erette, poco intrecciate, con cellule terminali arrotondate 10,7-15,3 µm di diametro. Osservazione in rosso Congo ammoniacale, a 400×. Regione Umbria; Ottobre 2021; Legit Giulio Savantonio, Foto di Francesca Barchiesi. (exsiccatum GG211005-01) Acquarello di Francesca Barchiesi. (exsiccatum GG211005-01) -

Galerina paludosa (Fr.) Kühner 1935
Archivio Micologico ha postato un topic nell'area Funghi Non Commestibili o Sospetti
Galerina paludosa (Fr.) Kühner 1935 Tassonomia Divisione Basidiomycota Classe Agaricomycetes Ordine Agaricales Famiglia Hymenogastraceae Sinonimi Tubaria paludosa (Fr.) P. Karst. 1879 Etimologia L'epiteto Galerina è il diminutivo di Galera, dal latino Galerus = copricapo a forma di cupola di cuoio usato come elmo, per la forma del cappello. L'epiteto paludosa deriva dal latino pălūdōsus = paludoso, per il suo ambiente di crescita. Cappello Cappello convesso-campanulato, con orlo leggermente frastagliato, con un largo umbone appiattito, liscio, igrofano, brillante con il tempo umido, colore giallo-aranciato, ocra, nettamente striato per trasparenza per più della metà del cappello, mostra sul bordo degli esemplari giovani resti bianchi fibrillosi di velo. Imenoforo Le lamelle sono ascendenti, spaziate, ventricose, da giallo-ocracee a giallo rugginose con la maturazione delle spore, intervallate da numerose corte lamellule, filo lamellare discolore, più chiaro per la presenza di cheilocistidi. Gambo Il gambo è cilindrico, mielato, fragile, non pruinoso, con piccoli fiocchi bianchi di velo fibrilloso-cotonoso e un anello bianco non sempre ben delimitato. Carne La carne è concolore al gambo, odore neutro. Habitat Sfagnicola. Microscopia Spore (8,8) 9,3-10,9 (11,5) × (5,8) 5,9-6,6 (7,1) µm; Q = (1,4) 1,5-1,7 (1,9); N = 39; Media = 10,0 × 6,3 µm; Qm = 1,6; amigdaliformi-citriformi, finemente verrucose, destrinoidi, non caliptrate. Basidi clavati, tetrasporici. Cheilocistidi lageniformi, subcapitulati e capitulati. Pleurocistidi assenti. Caulocistidi presenti solo nella parte alta del gambo, simili ai cheilocistidi. GAF presenti. Commestibilità e tossicità Non commestibile. Specie simili Galerina sphagnorum vive anch'essa in ambiente di sfagni, ma ha velo evanescente, che non forma una zona anulare, cheilocistidi più stretti. Galerina cephalotricha, Galerina mniophila e Galerina pseudomniophila non vivono in ambiente di sfagni. Bibliografia AA.VV., 2018. Funga Nordica. Agaricoid, boletoid and cyphelloid genera. Ed. Nordsvamp. 2nd Edition, 2nd printing. Scheda di proprietà AMINT realizzata da Tomaso Lezzi e Alessandro Gigli - Approvata e Revisionata dal CLR Micologico di AMINT. Regione Trentino-Alto Adige; Luglio 2022. CSP51, Dobbiaco (BZ) Crescita in Torbiera di montagna tra sfagni bagnati, in un periodo abbastanza siccitoso. Foto di Tomaso Lezzi. Cappello igrofano. Esemplari che mostrano cappello igrofano e residui di velo bianco fibrilloso-cotonoso distribuito lungo il gambo. Foto di Alessandro Gigli Esemplare giovane con abbondanti resti di velo bianco e fibrilloso lungo il margine del cappello. Foto di Alessandro Gigli. Cheilocistidi lageniformi, subcapitulati e capitulati. Osservazione in rosso Congo, a 1000×. Foto di Alessandro Gigli. Cheilocistidi lageniformi, subcapitulati e capitulati. Osservazione in rosso Congo, a 200×. Foto di Tomaso Lezzi. Cheilocistidi lageniformi, subcapitulati e capitulati. Osservazionein rosso Congo, 400×. Foto di Tomaso Lezzi. Cheilocistidi lageniformi, subcapitulati e capitulati. Osservazione in rosso Congo, a 400×. Foto di Alessandro Gigli. Spore (8,8) 9,3-10,9 (11,5) × (5,8) 5,9-6,6 (7,1) µm; Q = (1,4) 1,5-1,7 (1,9); N = 39; Media = 10,0 × 6,3 µm; Qm = 1,6; amigdaliformi-citriformi, finemente verrucose, destrinoidi, non caliptrate. Osservazione in rosso Congo, a 1000×. Foto di Alessandro Gigli. -

Mallocybe terrigena (Fr.) Matheny, Vizzini & Esteve-Rav. 2019
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Velenosi
Mallocybe terrigena (Fr.) Matheny, Vizzini & Esteve-Rav.; Regione Umbria; Dicembre 2020; Foto di Tomaso Lezzi. Inocybe dal caratteristico gambo coperto di squame rialzate e di un anello nella parte alta. Spore (8,8) 9,4-12,4 (13,8) × (5,6) 5,8-7,2 (7,4) µm; Q = (1,5) 1,52-1,9 (2,0); N = 32; Media = 10,9 × 6,4 µm; Qm = 1,7; ellissoidali, faseoliformi. Cheilocistidi clavati, settati. Pleurocistidi non osservati. Gambo formato da una cutis di ife cilindriche parallele. Spore (8,8) 9,4-12,4 (13,8) × (5,6) 5,8-7,2 (7,4) µm; Q = (1,5) 1,52-1,9 (2,0); N = 32; Media = 10,9 × 6,4 µm; Qm = 1,7; ellissoidali, faseoliformi. Osservazione in rosso Congo, a 400×. Cheilocistidi clavati, settati. Osservazione in rosso Congo, a 400×. Ife del gambo, cilindriche parallele. Osservazione in rosso Congo, a 200×.- 7 risposte
-
- pholiota terrigena
- inocybe terrigena
- (e 1 in più)
-

Lactarius dryadophilus Kühner 1975
Archivio Micologico ha postato un topic nell'area Funghi Non Commestibili o Sospetti
Lactarius dryadophilus Kühner 1975 Tassonomia Divisione Basidiomycota Classe Agaricomycetes Ordine Russulales Famiglia Russulaceae Genere Lactarius Sottogenere Piperites Sezione Uvidi Sottosezione Aspideini Etimologia L'epiteto Lactarius deriva dal latino lactarius = lattaio, per la presenza del latice. L'epiteto dryadophilus deriva dal greco δρῦς [drýs] = quercia, per la forma delle foglie dell'erba perenne Dryas octopetala appartenente alla famiglia delle Rosaceae, tipica dell'ambiente di micro selva alpina e dall'aggettivo greco φίλος [philos] = amante di, che ha amore, simpatia, tendenza, affine a, per la simbiosi che questa specie ha con Dryas octopetala. Cappello Diametro 4-10 cm, Inizialmente convesso, diviene successivamente piano convesso, con lieve depressione centrale, margine, sottile, regolare, leggermente involuto, anche in età tardiva, privo di striature o costolature, ma con aspetto pubescente o lievemente villoso, carattere ben osservabile soprattutto negli esemplari immaturi, infine con aspetto quasi liscio o glabro. Superficie, vischiosa, glutinosa con tempo umido, asciutta in condizioni siccitose, liscia, leggermente ruvida verso il centro, non zonata, di color crema biancastro, avorio giallino, con presenza di rade fibrille riunite a ciuffetti dalle tonalità ocraceo giallastre. Imenoforo Lamelle, da sottili a mediamente spesse, da adnate a sub decorrenti, inizialmente fitte, poi leggermente più spaziate, di colore crema biancastro, avorio, con svariate anastomosi e biforcazioni distribuite in maniera irregolare sulla superficie imeniale, ma maggiormente concentrate verso il gambo, sono presenti numerose lamellule. Nelle zone contuse, sono evidenti macchie che inizialmente assumono una tonalità lilla-violacea, poi col passare dei minuti lillacino brunastra, condizione dovuta al viraggio del latice a contatto con le lamelle. Latice Bianco, poco abbondante, vira su toni lilla-violacei a contatto con le lamelle, sapore mite. Gambo Cilindrico, regolare, tozzo, più corto rispetto al dimetro del cappello, negli esemplari di maggior dimensioni leggermente attenuato e ricurvo verso la base, liscio, concolore al cappello, scrobicoli assenti o sporadici, tende a macchiarsi di giallo paglierino, ocraceo verso la base. Carne Soda e compatta, esternamente dalle colorazioni crema biancastre, avorio, con leggere sfumature giallo ocracee; internamente di colore bianco, virante su toni lilla-violacei, maggiormente nella zona corticale del gambo. Odore leggero, fruttato; sapore mite. Habitat Specie legata agli ambienti di microselva alpina, con predilezione per Dryas octopetala e Salix retusa. Microscopia Spore (8,0) 8,4-10,3 (10,5) × (6,7) 7,1-8,7 (9,5) µm; Q = (1,0) 1,1-1,3 (1,4); N = 30; Media = 9,3 × 7,9 µm; Qm = 1,2; crestato-subreticolate, con presenza sia di rade connessioni tra le creste, che di verruche ottuse ed isolate. È ben visibile la presenza di uno pseudoreticolo che presenta rare maglie chiuse e complete. Basidi tetrasporici. Macrocistidi generalmente fusiformi o subfusiformi, con apice attenuato e moniliforme, numerosi e nettamente emergenti dai tessuti imeniali. Pileipellis con struttura a ixotrichoderma, costituito da ife sinuose, filiformi, gelificate, con apice sottile, appuntito. Commestibilità e Tossicità Non commestibile. Specie simili All'interno della sottosezione Aspideini, caratterizzata da carpofori dalle colorazioni crema, crema biancastre, avorio, latice bianco virante su toni lilla-violacei, simili a Lactarius dryadophilus, con medesima e caratteristica ecologia, costituita appunto da ambienti di microselva alpina con presenza di Dryas octopetala e Salix spp., troviamo: Lactarius salicis-reticulatae Kühner, macroscopicamente si differenzia per la taglia decisamente inferiore 2,5-4,5 cm, la cuticola maggiormente glutinosa, il margine del cappello non villoso; microscopicamente per le spore più piccole, la differente conformazione della pileipellis con struttura intermedia tra ixocutis e ixotrichoderma con la presenza di rade ife emergenti; Lactarius salicis-herbaceae Kühner, a livello macroscopico la taglia di questa specie, 1,3-2,5 cm, è di molto inferiore a quella più grande e massiccia di L. dryadophilus; oltre a questo carattere L. salicis-herbaceae si differenzia per avere tonalità dal cappello nettamente più giallo ocracee e non crema biancastre e margine del cappello non pubescente; microscopicamente differisce per avere spore più piccole e differente conformazione della pileipellis costituita da una ixocute mista ad ixotrichoderma, come nel caso di L. salicis-reticulatae. Bibliografia BASSO, M.T., 1999. Lactarius Pers. Fungi Europæi. Vol 7. Alassio (SV): Ed. Mykoflora. Scheda di proprietà AMINT realizzata da Alessandro Gigli e Tomaso Lezzi - Approvata e Revisionata dal CLR Micologico di AMINT. Regione Trentino Alto-Adige, Passo Vizze; Luglio 2022; Foto di Alessandro Gigli. (Exsiccata AG220725-04, TL220728-01) Ritrovamento in zona alpina. Foto di Tomaso Lezzi. Sulla sinistra il latice bianco che emerge dal taglio appena fatto, sulla destra il latice virato al lilla-violaceo a contatto con le lamelle. Sulla sinistra il latice bianco appena fuoriuscito dalle lamelle, sulla destra, in basso, il latice virato al lilla-violaceo a contatto con le lamelle. Foto di Alessandro Gigli. Spore (8,0) 8,4-10,3 (10,5) × (6,7) 7,1-8,7 (9,5) µm; Q = (1,0) 1,1-1,3 (1,4); N = 30; Media = 9,3 × 7,9 µm; Qm = 1,2; crestato-subreticolate, con presenza sia di rade connessioni tra le creste, che di verruche ottuse ed isolate. È ben visibile la presenza di uno pseudoreticolo che presenta rare maglie chiuse e complete. Osservazione in melzer, a 1000×. Pileipellis con struttura a ixotrichoderma, costituito da ife sinuose, filiformi, gelificate, con apice sottile, appuntito. Osservazione in rosso Congo, a 400×. Macrocistidi generalmente fusiformi o subfusiformi, con apice attenuato e moniliforme, numerosi e nettamente emergenti dai tessuti imeniali. Osservazione in rosso Congo, a 400×. -
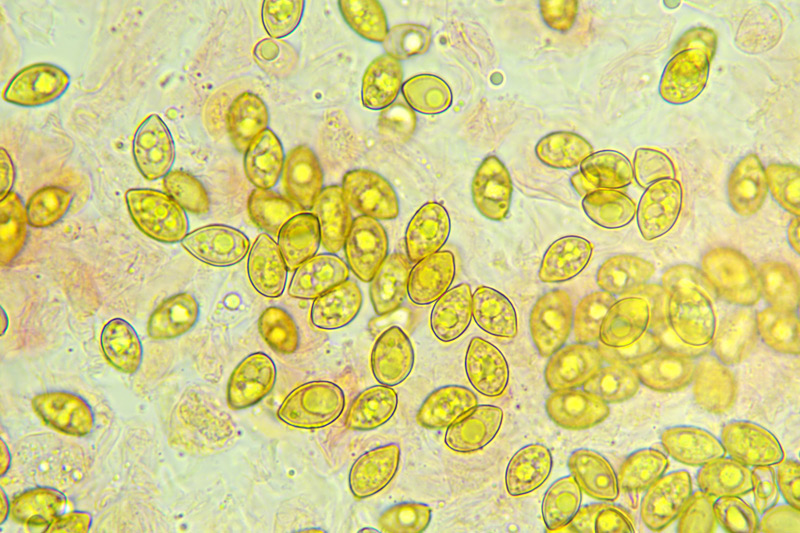
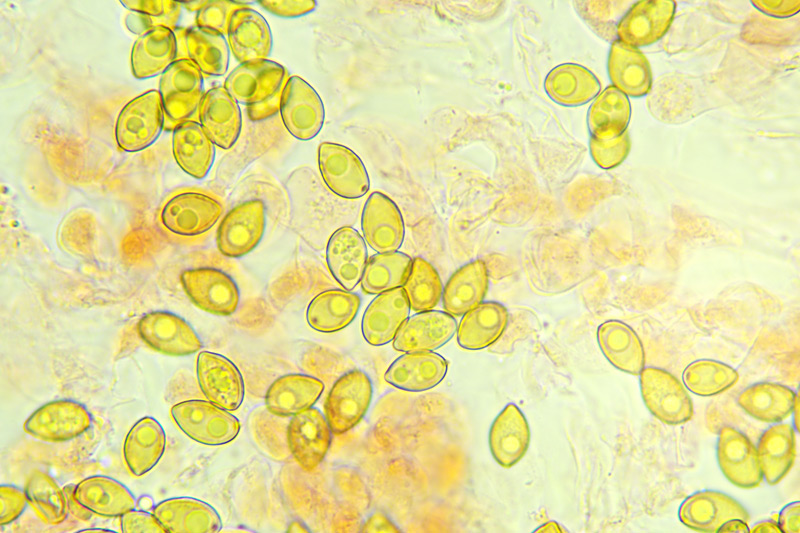
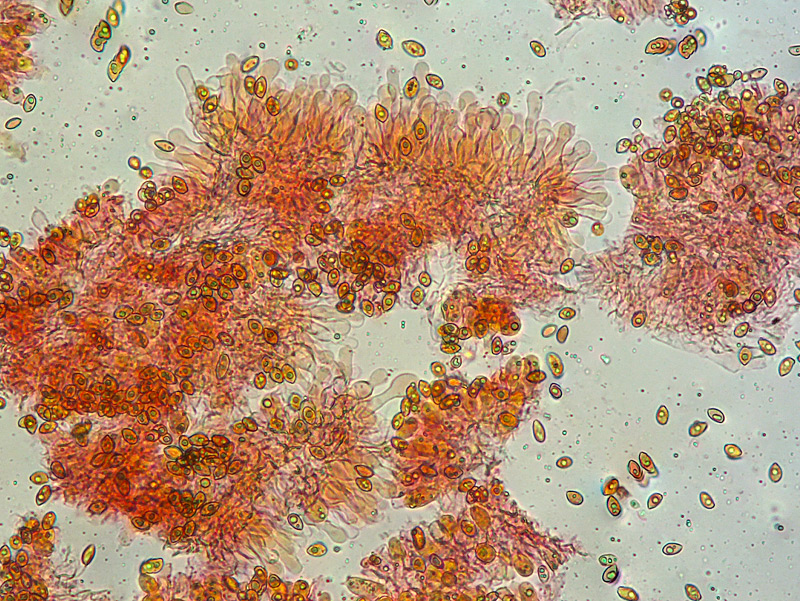
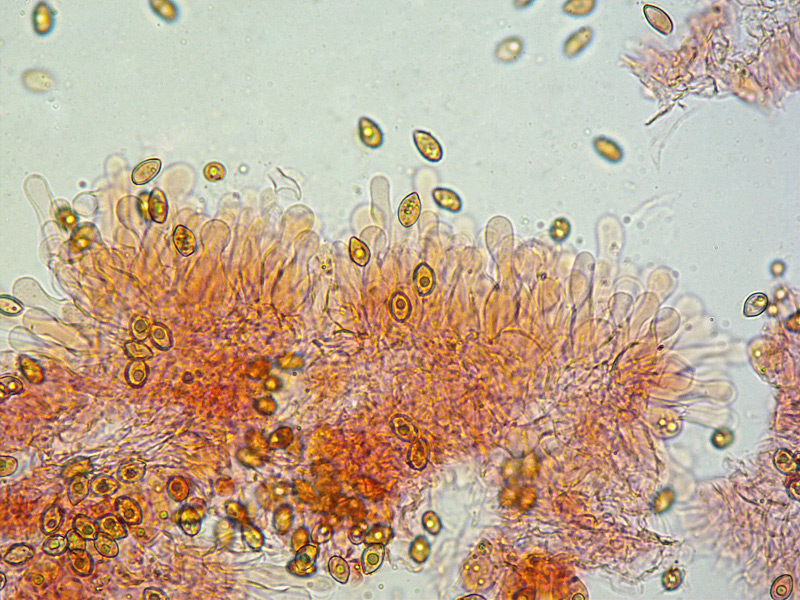
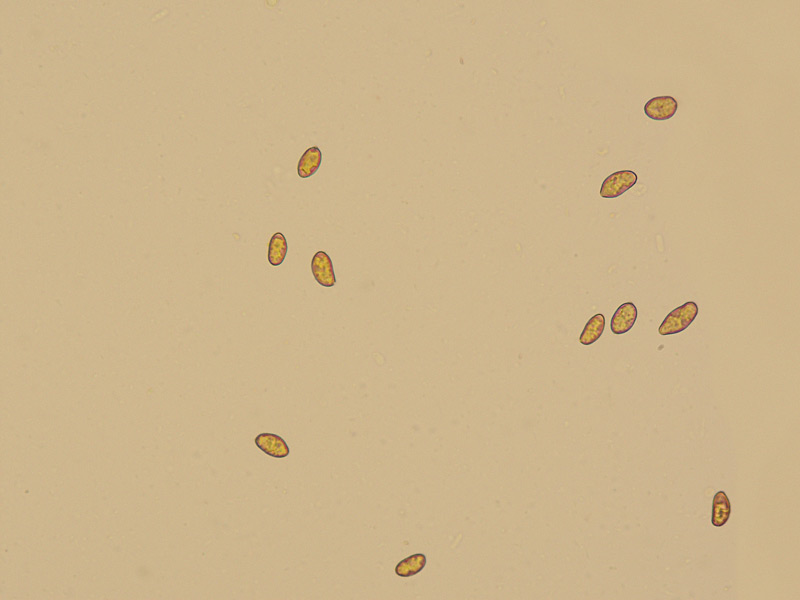
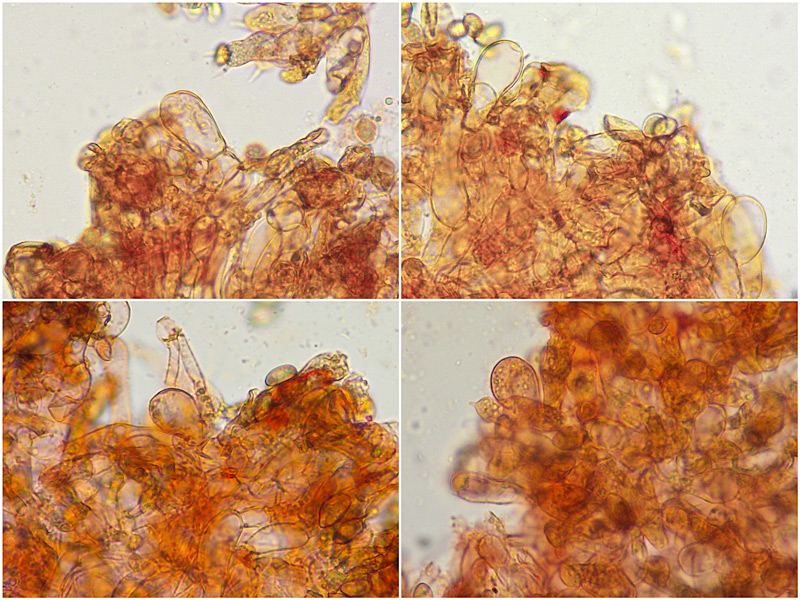
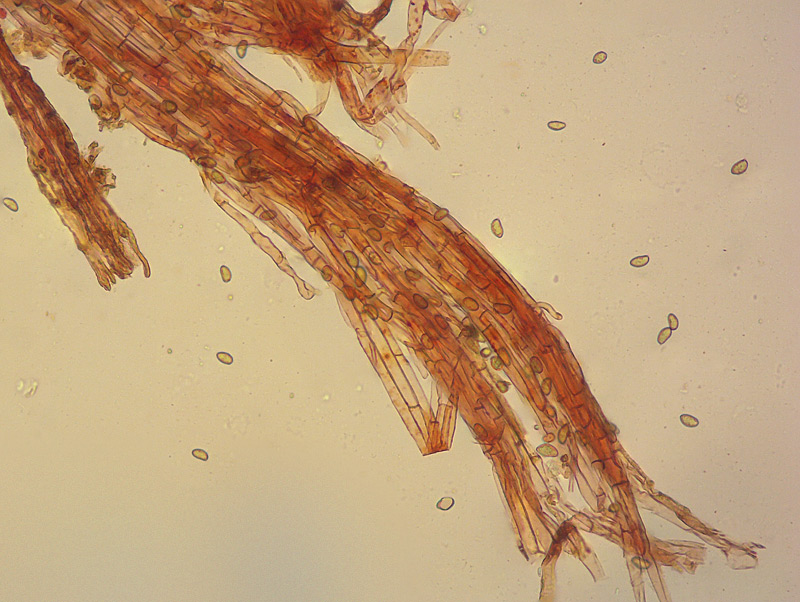
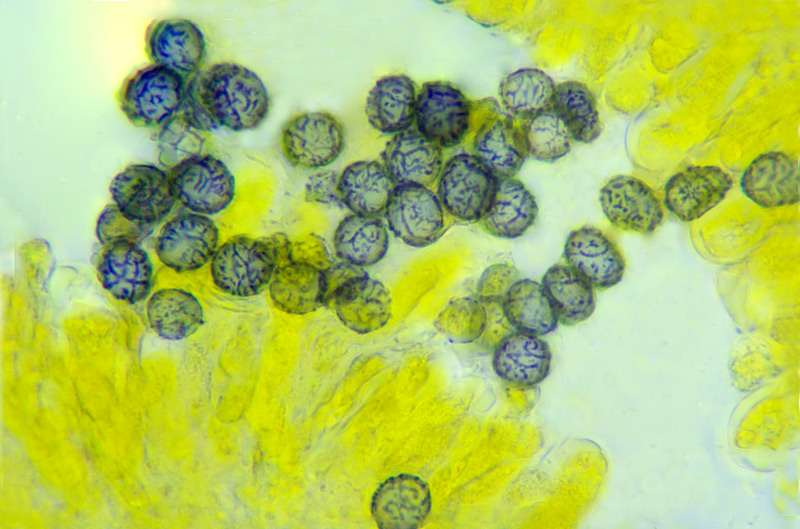
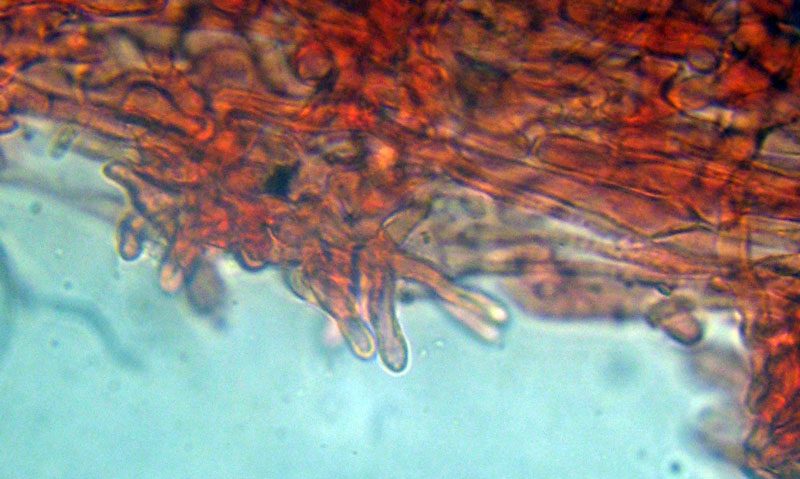
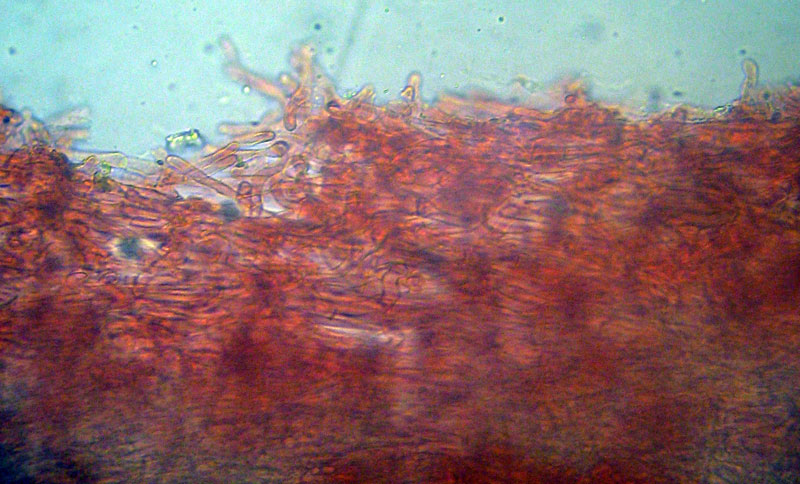
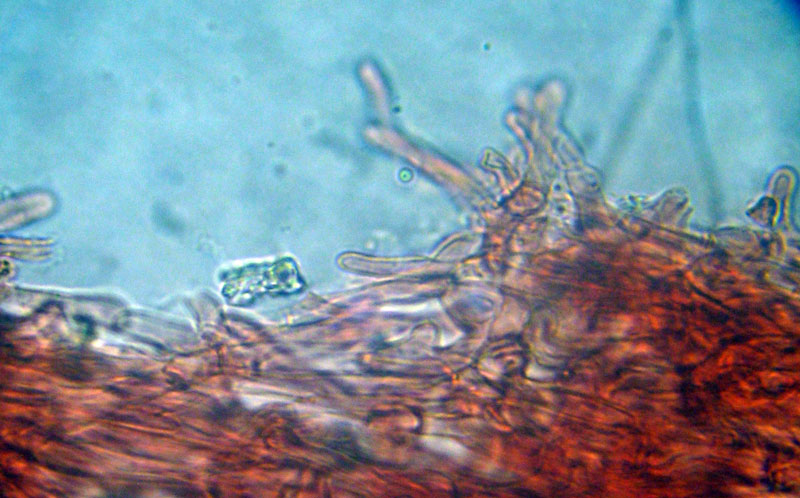
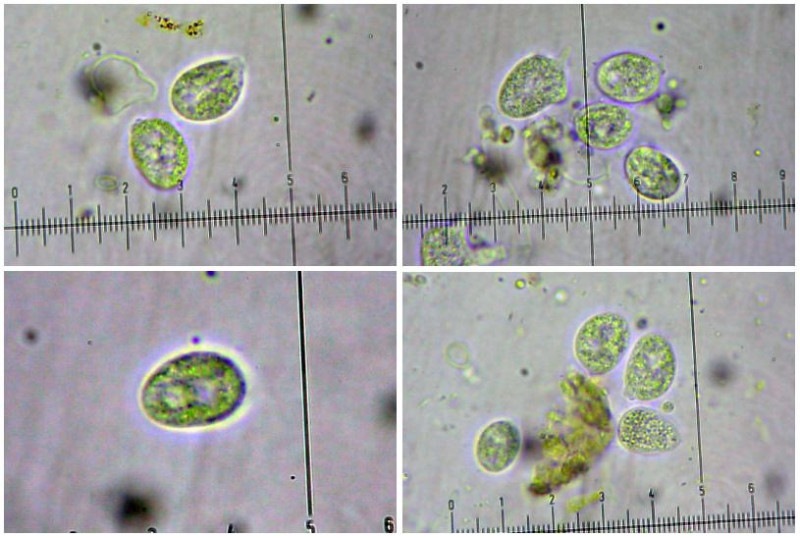
Inocybe queletii Konrad 1929 Tassonomia Divisione Basidiomycota Classe Agaricomycetes Ordine Agaricales Famiglia Inocybaceae Genere Inocybe Sezione Tardae Sottosezione Geophyllinae Sinonimi Inocybe eutheles var. queletii (Maire & Konrad) R. Heim 1931 Etimologia L'epiteto Inocybe deriva dal greco ἴς/ἴνος [is/inos] = fibra e "κύβη" [cýbe] = testa, per il cappello spesso tomentoso o dissociato in fibre. L'epiteto queletii è dedicato al micologo francese Lucien Quélet. Cappello Carpoforo con portamento tricolomatoide, il pileo misura da 3 a 7 cm, inizialmente convesso poi campanulato, a volte con margine revoluto, presenta umbone largo e ottuso mai completamente spianato. La cuticola è inizialmente ricoperta da un sottile velo, formato da una cortina biancastra e detersile, a maturazione quando il velo si dissolve, assume un colore bruno ocraceo e si può apprezzare una leggera rimosità, resti di velo cortiniforme, si possono osservare anche al margine del cappello di giovani soggetti. Lamelle Lamelle moderatamente spaziate, ventricose, alternate a lamellule, da adnate, a smarginate all’inserzione con il gambo, bianche nei soggetti giovani, assumono tonalità ocra mielato a maturazione, il filo lamellare si presenta discolore e finemente eroso. Gambo Tozzo, cilindrico, a volte leggermente sinuoso, allargato alla base, il colore di fondo, ocraceo sfumato di rosa, è ricoperto da una patina biancastra, e nella parte alta vicino all’inserzione con l’imenoforo, è ricco di granelli forforacei. La base da clavata a bulbosa, ingloba grosse quantità di residui terrosi e organici, il micelio basale è biancastro. Carne La carne alla sezione del carpoforo, è di consistenza esigua sul cappello, biancastra, compatta e fibrosa sul gambo. Odore erbaceo, appena raccolto e successivamente intenso e spermatico. Habitat Specie primaverile, si rinviene in bosco di conifere, con presenza di Abies alba, Pinus nigra e Taxus baccata. Microscopia Cheilocistidi (45,8) 48,3-67,9 (71,1) × (12,3) 15,1-19,5 (20,7) µm; Q = (2,7) 2,8-3,8 (4,2); N = 20; Media = 58,2 × 17,4 µm; Qm = 3,3 muricati, con cristalli di piccola taglia abbondanti all'apice, prevalentemente fusiformi, subfusiformi, alcuni clavati. Pleurocistidi (51,0) 56,4-71,0 (71,1) × (14,8) 15,1-16,4 (17,4) µm; Q = 3,4-4,3 (4,7); N = 6; Media = 61,4 × 15,7 µm; Qm = 3,9 muricati simili ai cheilocistidi. Paracistidi abbondanti, lisci e clavati. GAF osservati in tutti i tessuti, particolarmente evidenti alla base dei cistidi e paracistidi. Basidi clavati, tetrasporici e bisporici. Spore (9,3) 9,6-10,9 (11,3) × (4,9) 5,0-5,9 (6,4) µm; Q = (1,7) 1,8-2,0 (2,2); N = 42; Media = 10,3 × 5,5 µm; Qm = 1,9; amigdaliformi in vista laterale, ellissoidali in quella frontale, con apice acuto a punta di proiettile. Caulocistidi in gruppi folti, simili ai cistidi imeniali, evidenti solo nella prima parte dello stipite, accompagnati da un nutrito numero di paracaulocistidi clavati non muricati, con GAF sui setti. Commestibilità e tossicità Si ritiene velenosa come tutte le Inocybe, con sindrome muscarinica. Per approfondimenti consulta la Pagina di Micotossicologia. Osservazioni Macroscopicamente è simile a molte specie appartenenti a questo complicato genere, a permetterne la corretta determinazione ci aiutano la crescita primaverile, il velo biancastro che ricopre i giovani carpofori, l'habitat in prevalenza sotto conifere, l'odore spermatico e l'insieme dei caratteri microscopici. Specie simili Inocybe sambucina (Fr. : Fr.) Quel. simile morfologicamente, cresce in autunno nei boschi di Pinus spp., e si differenzia per avere spore quasi cilindriche, leggermente irregolari, con misure 7-10 x 3,5-5 μm. Inocybe whitei (Berk. & Br.) Sacc. cresce prevalentemente sotto latifoglia, i carpofori tendono ad arrossare, le spore sono ovoidali-ellissoidali, con misure 8-9,5 x 4,5-5,5 μm. Bibliografia AA.VV., 2012. Funga Nordica. Agaricoid, boletoid and cyphelloid genera. Ed. Nordsvamp. VIZZINI, A., DELLA MAGGIORA, M., TOLAINI, F. & ERCOLE, E., 2013. A new cryptic species in the genus Tubariomyces (Inocybaceae, Agaricales). Mycological Progress. 12(2): 375-381. Fungi of Temperate Europe: Volume 1+2 di Laessoe, Thomas, Petersen, Jens H. Scheda di proprietà AMINT realizzata da Giovanni Galeotti - Approvata e Revisionata dal CLR Micologico di AMINT. Regione Umbria; Aprile 2022; Foto e microscopia di Giovanni Galeotti. (Exsiccatum GG220425-01) Campioni rinvenuti durante il raduno AMINT in Umbria; ritrovamento di Mario Iannotti; soggetti rinvenuti sotto conifere. Campioni rinvenuti a distanza di due giorni, ritrovamento di Giovanni Galeotti nella stessa località, che confermano habitat, dati macro e microscopia. (Exsiccatum GG220426-02) In foto si può osservare il velo biancastro, che ricopre i soggetti giovani, maturando si dissolve lentamente, il pileo assume a quel punto un colore di fondo bruno ocraceo. Cheilocistidi, molto abbondanti. Osservazione in rosso Congo, a 100×. Cheilocistidi (45,8) 48,3-67,9 (71,1) × (12,3) 15,1-19,5 (20,7) µm; Q = (2,7) 2,8-3,8 (4,2); N = 20; Media = 58,2 × 17,4 µm; Qm = 3,3 muricati, con cristalli di piccola taglia abbondanti all'apice, prevalentemente fusiformi, subfusiformi, alcuni clavati. Osservazione in rosso Congo, a 400×. Pleurocistidi (51,0) 56,4-71,0 (71,1) × (14,8) 15,1-16,4 (17,4) µm; Q = 3,4-4,3 (4,7); N = 6; Media = 61,4 × 15,7 µm; Qm = 3,9 muricati simili ai cheilocistidi leggermente più grandi. Osservazione in rosso Congo, a 400×. Pleurocistidi a parete spessa. Osservazione in rosso Congo, a 1000×. Caulocistidi in gruppi folti, simili ai cistidi imeniali, evidenti solo nella prima parte dello stipite, accompagnati da un nutrito numero di paracaulocistidi clavati non muricati, con GAF sui setti. Osservazione in rosso Congo, a 400×. Basidi in prevalenza tetrasporici. Osservazione in rosso Congo, a 400×. Osservazione in rosso Congo, a 1000×. Spore (9,3) 9,6-10,9 (11,3) × (4,9) 5,0-5,9 (6,4) µm; Q = (1,7) 1,8-2,0 (2,2); N = 42; Media = 10,3 × 5,5 µm; Qm = 1,9; amigdaliformi in vista laterale, ellissoidali in quella frontale. Osservazione in rosso Congo, a 1000×.
-

Lactarius subdulcis (Pers. : Fr.) Gray 1821
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Lactarius subdulcis (Pers. : Fr.) Gray; Regione Lombardia, località Ripa di Gromo alta val Seriana; Settembre 2009; Foto di Massimo Biraghi. (Exsiccata MB20090922-107 - MB20090922-148) Cappello inizialmente un poco convesso e a volte con presenza di una piccola papilla centrale, presto disteso, leggermente a forma di imbuto in maturità, colorazioni pileiche che possono variare su toni nocciola, beige, camoscio chiaro, brunastro, ma sempre con evidenti sfumature rosate o leggermente rossicce, che impallidisce in vecchiaia o con tempo asciutto specie al margine, quest'ultimo è di spessore sottile e generalmente ondulato. Cuticola liscia o leggermente gibbosa con presenza di piccole fibrille radiali, di aspetto opaco con tempo secco, lucida e un poco untuosa con tempo umido. Lamelle mediamente fitte e intercalate da numerose lamellule di varia lunghezza, da adnate a leggermente decorrenti e con qualche forcatura al gambo in maturità, di colore crema molto chiaro con sfumature rosate in gioventù, tendono a sporcarsi di brunastro con l'età o nelle lesioni, filo concolore o leggermente più chiaro negli esemplari adulti. Gambo cilindrico o appena attenuato verso la base, a volte anche ricurvo, pruinoso o con sottili rugosità, di colore più pallido del cappello nella parte mediana, su toni crema nella parte vicino alle lamelle e con piccola feltratura biancastra alla base, di consistenza fragile, farcito e presto cavo. Carne scarsa, abbastanza soda nei giovani esemplari, poi molliccia, generalmente biancastra, imbrunente dopo alcuni minuti a contatto con l'aria, di sapore inizialmente dolciastro poi un poco astringente e leggermente amarognola, odore complesso, che ricorda gli Scleroderma, cimicino. Latice non molto abbondante, di colore biancastro, immutabile, mite ma poi amarognolo. Specie legata alle foreste di Fagus sylvatica, puri o frammisti ad Abies alba. Spore (6,5) 7-8 (8,5) × 5,5-6,5 µm, da subglobose a ellissoidali con verruche che non superano 1 µm, isolate o anche riunite da sottili creste che possono formare un reticolo incompleto ed alcune maglie chiuse. Basidi e macrocistidi di forma banale, caulocistidi assenti. Caulopellis composta da ife tendenzialmente cilindriche con qualche elemento a salsicciotto o di forma oblunga. Specie strettamente legata a Fagus sylvatica, Lactarius subdulcis mostra colorazioni pileiche simili ad altri Lactarius che rendono problematico il suo riconoscimento specie sul campo. La superficie pileica di aspetto glabro, mai con evidenti rugosità, colloca questa entità nella sezione Russulares (Fr.) Fr. La specie più vicina è Lactarius sphagneti che può avere analoghe colorazioni pileiche ma predilige l'habitat di foreste di conifera umide e ricche di sfagni, inoltre ha odore debole e latice pressoché mite. Microscopicamente presenta spore ornate da creste spesso concatenate e con fini connessioni, le quali formano una sorta di reticolo incompleto. Ancora più problematica è la separazione con Lactarius rubrotinctus visto l'identico habitat di crescita, ma che ha una superficie pileica di aspetto rugoso con tipiche piccole macchie brunastre ben evidenti a maturazione, caratteristica saliente è una sorta di zona anulare di colore rosso-vinoso all'inserzione del gambo con le lamelle, che in alcune condizioni può essere anche assente. Microscopicamente si osservano decorazioni sporali formate da creste di varia lunghezza e unite da fini connessioni ma che non formano alcun tipo di reticolo come in Lactarius subdulcis. La presenza di numerosi caulocistidi toglie ogni eventuale dubbio. Lactarius fulvissimus cresce in preferenza nei boschi misti di Castanea sativa, Ostrya carpinifolia, Corylus avellana, presenta colorazioni pileiche su toni fulvo-aranciati e la cuticola è di aspetto asciutto con la tendenza a screpolarsi leggermente, il margine del cappello è crenulato, il gambo aranciato con la base più scura su toni bruno-rossastri, il latice è molto scarso, mite, immutabile sulle lamelle ma di color crema se isolato. Microscopicamente presenta una caulopellis di tipo tricoderma con terminali allungati, le spore sono decorate da verruche a spine coniche. Raccolta effettuata in bosco di puro Fagus sylvatica sempre nelle immediate vicinanze dell'albero o delle radici affioranti su terreno ricco di humus. Particolare della papilla presente sul cappello. Particolare dell'imenio e del gambo Spore 6,5-8,2 × 5,3-6,6 µm (valori medi 7,4-5,9 µm); Q=1,2-1,4; Qm=1,3. Decorazioni sporali. Caulopellis composta da ife cilindriche, assenza di caulocistidi. Caulopellis composta da ife cilindriche, assenza di caulocistidi. -

Tremella mesenterica Retz. : Fr. 1769
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Tremella mesenterica Retz. : Fr.; Regione Lombardia, Gera d'Adda; Marzo 2013; Foto, commento e microscopia di Sergio Mombrini. Specie dai colori vivaci e dalla consistenza elastica gelatinosa, cresce su legname degradato di latifoglie, la vistosa colorazione va dal giallo tenue al rosso d'uovo, priva di odori e sapori significativi. L'aspetto del tutto singolare rende oltremodo semplice la determinazione. Su legno di latifoglie. Molto appariscente e inconfondibile, fruttifica nei periodi particolarmente umidi e piovosi. Spore 12,1-15,3 × 9,1-10,4 µm, ovoidali, lisce, ialine. Ife con presenza di pigmento vacuolare che gli conferisce il colore giallo-oro al basidiocarpo. Basidi 21-30 × 15-19 µm, subglobosi-ovoidali; sterigmi 14-60 × 2,4-3,6 µm, cilindrici.- 26 risposte
-
- tremella candida
- tremella mesenterica
- (e 3 in più)
-

Pholiotina arrhenii (Fr.) Singer 1973
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Pholiotina arrhenii (Fr.) Singer; Regione Lombardia, località Osio Sotto; Novembre 2005; Foto e descrizione di Massimo Biraghi. (Exsiccatum MB20051118-37) Cappello 1,2-3 cm, ocra-giallastro, più scuro al centro, igrofano, margine un poco striato. Lamelle ocra. Gambo, sericeo, bianco argenteto pruinoso/fibrillato con anello striato. Carne inodore. In un prato coperto di foglie. Particolare. -

Hortiboletus bubalinus (Oolbekk. & Duin) L. Albert & Dima, 2015
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Commestibili
Hortiboletus bubalinus (Oolbekk. & Duin) L. Albert & Dima; Regione Umbria; Novembre 2021; Foto di Mario Iannotti. Micelio giallastro alla base del gambo.- 3 risposte
-
- hortiboletus bubalinus
- xerocomellus bubalinus
- (e 2 in più)
-

Hortiboletus bubalinus (Oolbekk. & Duin) L. Albert & Dima, 2015
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Commestibili
Hortiboletus bubalinus (Oolbekk. & Duin) L. Albert & Dima; Regione Umbria; Novembre 2021; Foto di Pietro Curti. Sezione longitudinale: carne del cappello naturalmente rosa; viraggio nella parte superiore del gambo azzurro; viraggio nella parte mediana dello stipite verdastro; viraggio alla base del gambo brunastro; micelio al piede giallastro. Tubuli gialli, adnati o subdecorrenti. Pori irregolari, difformi e angolosi. Cappello fulvo e vellutato, finemente screpolato a maturità, cuticola che si decolora verso il margine assumendo tipiche tonalità rosate. Micelio al piede giallastro.- 3 risposte
-
- hortiboletus bubalinus
- xerocomellus bubalinus
- (e 2 in più)