Cerca nel Forum
Mostra i risultati per i TAG 'leucopaxillus agrippinae'.
Trovato 1 risultato
-

Leucopaxillus agrippinae Buda, Consiglio, Setti & Vizzini 2012
Archivio Micologico ha postato un topic nell'area Funghi Non Commestibili o Sospetti
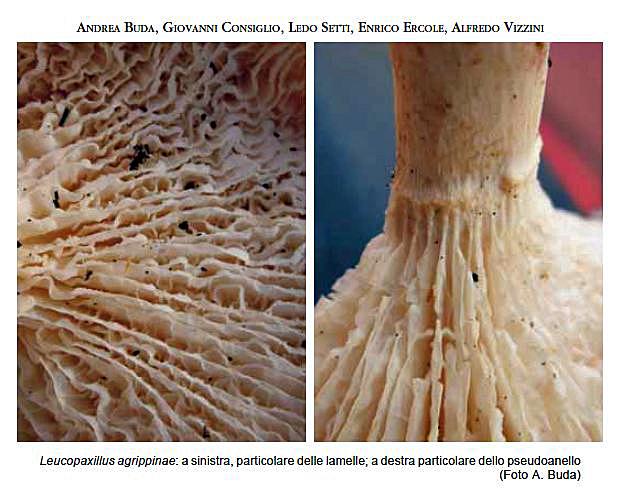
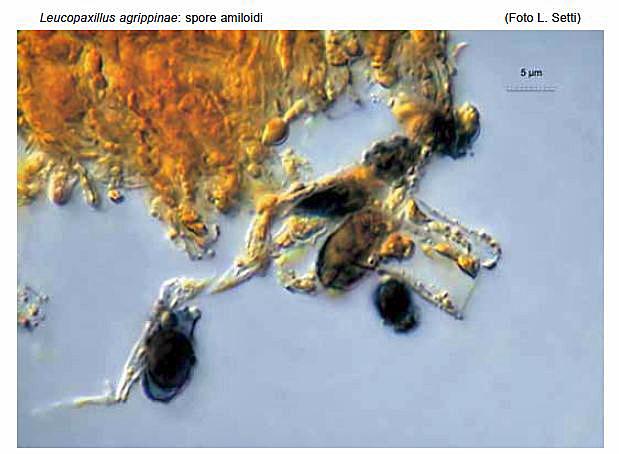
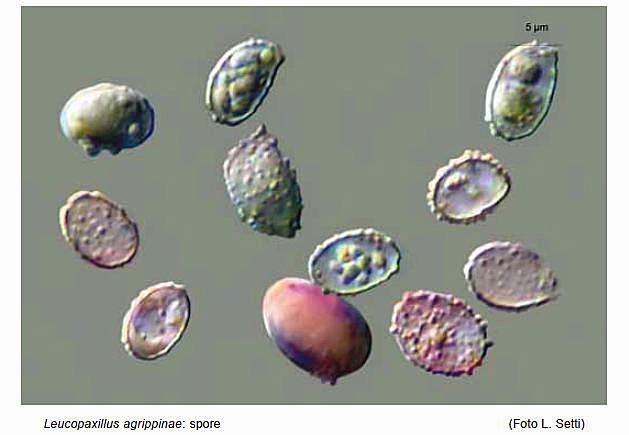
Leucopaxillus agrippinae Buda, Consiglio, Setti & Vizzini 2012 Tassonomia Divisione Basidiomycota Classe Basidiomycetes Ordine Agaricales Famiglia Tricholomataceae Etimologia Dedicato alla signora Agrippina, moglie di Andrea Buda. Cappello 40-100 mm, emisferico con largo umbone ottuso, poi spianato e infine irregolarmente depresso; orlo involuto, poi appena più disteso, fortemente lobato e ondulato, talora lievemente costolato a zone; cuticola integra, asciutta, opaca, granulosa per residui terrosi o vegetali inglobati dal substrato, inizialmente di colore biancastro, presto giallo-ocra che incupisce con l’età, infine arancione. Lamelle Mediamente fitte, fortemente decorrenti sul gambo senza o con pochissime anastomosi per circa 30 mm fino alla zona pseudoanulare, facce fortemente venose e ondulate che a tratti si uniscono a formare dei setti trasversali che conferiscono a tutto l’imenoforo un aspetto quasi labirintiforme-anastomizzato, sottili, fragili, larghe 5-12 mm, facilmente separabili dalla carne del cappello, dapprima biancastre, poi tendenti al giallo e infine al giallo-ocra; taglio non o finemente asperulato (lente), ondulato, sempre e caratteristicamente incurvato verso l’alto, dapprima concolore, in esemplari vecchi ocra-arancione; lamellule non visibili forse anche a causa della conformazione dell’imenoforo. Gambo 100-130 × 10-20 mm, cilindrico, generalmente eccentrico o appena laterale, sovente ricurvo, pieno, alla base è presente un feltro miceliare bianco inglobante il substrato, fibrilloso, da bianco-beige a giallo-ocra pallido; sotto l’inserzione delle lamelle è presente una formazione pseudoanulare che cinge il gambo con una banda araneoso-cotonosa larga circa 3 mm, in rilievo per 1-1,5 mm, concolore con il gambo. Carne Bianca, spessa al disco 15-18 mm, soda, compatta, poi appena elastica e infine molliccia, fibrosa nel gambo, non marcescente, tende spontaneamente a mummificare assumendo un colore giallo-ocra; odore poco gradevole, complesso, aromatico, in esemplari vecchi simile a quello di gamberoni arrosto; sapore subito sgradevole, talmente amaro da provocare abbondante salivazione. Habitat Specie saprotrofa, cresce in gruppi di diversi individui su substrato calcareo ricoperto da uno spesso strato di cascami e detriti vegetali degradati, in presenza di Cerro (Quercus cerris L.), dal tardo autunno al primo inverno. Microscopia Sporata bianca. Spore 6,8-8,4 × 4,6-5,7 μm, Q = 1,32-1,63, da ellissoidali a lungamente ellissoidali, fino a larmiformi, con contenuto opaco granulare oppure con un’unica grande goccia oleosa centrale, amiloidi in grigio molto accentuato, con verruche rade, larghe e piuttosto alte. La variabilità delle dimensioni è dovuta in gran parte alla presenza di basidi bisporici e monosporici. Basidi(poco numerosi), 23-35 × 6,7- 9,6 μm, tetrasporici, bisporici e raramente monosporici, clavati, con sterigmi lunghi fino a 6 μm; sono stati riscontrati sterigmi estremamente lunghi nei basidi monosporici, riportanti raramente un setto. Trama lamellare da regolare a subregolare, composta da ife larghe fino a 12,6 μm, ialine in L4, gialle in Melzer. Cheilocistidi: sono stati riscontrati numerosi pseudocistidi filiformi, emergenti dal substrato imeniale, cilindrici, con base corta o quasi assente, spesso settati, con misure fino a 50 × 3 μm, radi o ricoprenti a ciuffi l’orlo della lamella. Mescolati a questi pseudocistidi, sono state riscontrate numerose cellule sterili di forma clavata, subsferica, spesso catenulate, a volte lageniformi o a forma di palco di cervo.Pleurocistidi rari, simili ai cheilocistidi. Rivestimento pileico formato da una cutis di ife variamente intrecciate con radi terminali emergenti, con ife larghe fino a 13 μm, non gelificate, cilindroidi, terminanti in elementi indifferenziati, lisci, larghi 3-7 μm, con pigmento intracellulare di colore crema più o meno chiaro, alcune con finissimo pigmento incrostante la parete esterna; ife della trama cilindriche, larghe fino a 13 μm. Ife del gambo cilindriche, quelle interne larghe fino a 8 μm, quelle esterne larghe 2-5 μm, lisce, gialle in Melzer, terminanti in elementi indifferenziati, lisci, con apice arrotondato. Nella zona immediatamente sottostante alla parte terminale delle lamelle, si riscontra una struttura anulare araneosa-cotonosa, costituita da ife arruffate. Nella zona sottostante, distribuite fino alla base del gambo, sono visibili delle placchette superficiali, più membranose di quelle osservate nella zona alta, probabilmente dissociatesi durante la crescita del basidioma e residuo di una sorta di velo generale. Giunti a fibbia assenti in tutte le parti del basidioma. Commestibilità e Tossicità Specie di esclusivo interesse scientifico. Diagnosi latina Pileus 40-100 mm, hemisphaericus, lato umbone obtuso praeditus, deinde applanatus, demum incomposite depressus, margine involuto deinde recto, valde lobato vel undulato, interdum leviter costato; cuticula integra, sicca, opaca, primum albida, mox luteo-ochracea, demum aurantiaca, valde amara. Lamellae mediocriter confertae, valde decurrentes, valde anastomosae, tenues, fragiles, 5-12 mm latae, primum albidae deinde ad luteum colorem vergentes, demum luteoochraceae, acie haud vel tenuiter asperulata, undulata, facile separabiles a pilei carne. Stipes 100-130 x 10-20 mm, cylindricus, plerumque excentricus vel vix lateralis, saepe curvus, plenus, basi mycelio cotonoso atque substrati reliquis praedita, fibrillosus, albidus vel griseo-brunneus vel pallide luteo-ochraceus, sub lamellis zona pseudoanulari araneoso-cotonosa praeditus. Caro alba, 15-18 mm spissa ad discum, firma, compacta, deinde vix elastica, demum flaccida, in stipite fibrosa, haud marcescibilis, odore haud grato, aromatico, sapore statim ingrato, valde amaro. Sporarum pulvis albus. Sporae 6,8 8,4 × 4,6-5,7 μm, Q = 1,32-1,63, ellipsoideae vel longe ellipsoideae, usque ad larmiformes, contento opaco granuloso vel una guttula oleosa praeditae, amyloideae, verrucis raris, latis atque salientibus. Basidia 23-35 × 6,7-9,6 μm, tetraspora, bispora, raro unispora, clavata, sterigmatibus usque ad 6 μm. Cheilocystidia (pseudocystidia) filiformia, cylindrica, saepe septata, usque ad 50 × 3 μm. Pleurocystidia rara, cheilocystidiis similia. Pileipellis ex cute hyphis varie intermixtis, usque ad 13 μm latis, haud gelatinis, laevibus, cylindraceis, pigmento intracellulari plus minusve obscuro, nonnullis tenuissimo pigmento incrustanti, efformata. Fibulae absunt ubique. Habitatio numerose gregaria in solo calcareo spisso strato arborum reliquorum obtecto, cum Quercu cerris L., autumno-hieme. Holotypus in loco Santa Maria, prope Buccheri (SR) dicto, in nemore mixto, sub Quercu cerris, 17.X.2010 lectus, legit A. Buda, in Herbario AMB sub n. 12554 conservatus est. Diagnosi Inglese Pileus 40-100 mm broad, at first hemispheric, with a large obtuse umbo, then applanate and irregularly depressed in the centre when mature, margin involute then almost straight, strongly lobed-undulate, sometimes slightly ribbed; surface dry, mat, not diffracted-squamose, at first whitish, soon yellow-ochre, finally orange, with strongly bitter taste. Lamellae quite crowded, long decurrent, strongly intervenose, thin, fragile, 5-12 mm broad, easily separable from the pileus context white, becoming yellow, finally yellow-ochre; edges undulate, entire or minutely fringed. Stipe 100-130 × 10-20 mm, cylindric, usually eccentric or slightly lateral, often curved, stuffed, the base often with copious white tomentum with adhering leaves and woody debris, fibrillose, whitish, then grey-brownish to light yellow-ochre, with a white arachnoid-woolly ring-like zone at apex. Context white,15-18 mm thick at pileus centre, solid, firm, then slightly elastic, finally soft, fibrous in the stipe, not marcescent; smell unpleasant, aromatic; taste soon unpleasant, strongly bitter. Spore-print white. Spores 6.8-8.4 × 4.6-5.7 μm, Q = 1.32-1.63, ellipsoid to oblong, sometimes lacrymoid, with granular content or a single central oil drop, with an amyloid ornamentation of high and large scattered warts. Basidia 23-35 × 6.7-9.6 μm, four-, two- to rarely one-spored, clavate, with sterigmata up to 6 μm long. Cheilocystidia (pseudocystidia) thread-like, cylindric, often septate, up to 50 × 3 μm. Pleurocystidia scattered, similar to cheilocystidia. Pileipellis a xerocutis of interwoven and thin-walled, up to13 μm wide, cylindrical hyphae; pigment intracellular, sometimes minutely encrusting. Clamp connections absent. Habitat gregarious, on Quercus cerris litter, on calcareous soil. Fruiting in autumnwinter. Holotypus Italy, Buccheri (SR, Santa Maria, mixed forest with Quercus cerris, 17 October 2010, leg. A. Buda (AMB 12554). Riassunto Viene descritta e confrontata con alcune congeneri vicine una nuova specie di Leucopaxillus, raccolta nel bosco di Santa Maria ubicato nel territorio del Comune di Buccheri (SR). Abstract A new Leucopaxillus species, collected in Santa Maria wood (Buccheri-SR), is described and compared with similar species. Key words: Leucopaxillus agrippinae sp. nov., taxonomy, molecular analysis, Sicily, Italy. Introduzione La specie in trattazione è stata reperita per la prima volta nel mese di Novembre 2003 durante un’escursione in occasione del Comitato Scientifico del Gruppo A.M.B. di Siracusa. Da allora viene rinvenuta ogni anno, nel periodo tardo autunnale, sempre nella stessa stazione di crescita. Questa è situata a ca. 900 m s.l.m., nel bosco di Santa Maria, di proprietà del Demanio Regionale, e costituisce la zona boscata più alta dell’areale ibleo. Il bosco è costituito da un misto di Pino domestico (Pinus pinea L.), Cerro (Quercus cerris L.), Leccio (Quercus ilex L.), Roverella (Quercus pubescens Willd.), Sughera (Quercus suber L.), Castagno (Castanea sativa Miller) e qualche esemplare di Robinia (Robinia pseudoacacia L.) ed Eucalipto (Eucalyptussp.). La stazione di crescita è prevalentemente occupata da Cerro e il suolo è coperto abbondantemente dai cascami vegetali di questa essenza. La possibilità di rinvenire la specie costantemente ogni anno, ha permesso di stabilire che alcune sue peculiarità non sono riscontrabili in altre specie del Genere Leucopaxillus Boursier; la proponiamo, quindi, come una specie nuova. Materiali e metodi La descrizione dei caratteri macroscopici è stata compilata attraverso lo studio di materiale fresco. I caratteri microscopici sono stati rilevati su materiale d’erbario, lasciato rigonfiare in acqua e osservato immediatamente in soluzione di L4 con tracce di rosso Congo. Le misurazioni delle spore sono state effettuate fotografando, di volta in volta, tutte le spore presenti nel campo visivo del microscopio, in modo da soddisfare il principio della casualità, e usando il programma Mycomètre (FANNECHÈRE, 2011). Le dimensioni sono state rilevate escludendo l’apicolo e l’ornamentazione. I valori biometrici dei caratteri microscopici sono stati indicati secondo la metodologia di CONSIGLIO & SETTI (2008). Le abbreviazioni dei nomi degli autori sono tratte da KIRK & ANSELL (2003). Raccolte studiate 24.11.2007 (TO AVL20114 - GenBank acc. number JQ639159), 15.11.2008, 17.10.2010 (Holotypus AMB 12554, duplo in TO AVL20115 - GenBank acc. number JQ639160), 10.11.2011, 10.12.2011. Tutte le raccolte sono state effettuate da Andrea Buda nella medesima stazione di crescita. Risultati e discussione Il Genere Leucopaxillus, tipificato da L. paradoxus (Costantin & L.M. Dufour) Boursier 1925, è stato collocato da SINGER (1986) nella SottotribùLeucopaxillinae Singer 1986 (Tribù Leucopaxilleae Singer 1948) della Famiglia Tricholomataceae R. Heim 1934 ex Pouzar 1983 dell’Ordine AgaricalesUnderw. 1899, assieme al Genere Melanoleuca Pat. I due Generi della Sottotribù sono definiti in modo da comprendere specie con spore dotate di ornamentazione amiloide costituita da verruche o spinule isolate o parzialmente connesse su un fondo molto meno amiloide oppure non amiloide; se le spore sono lisce, i basidiomi sono giganteschi oppure grandi e carnosi. Nella concezione attuale (VIZZINI, 2009; VIZZINI ET AL., 2012), il Genere Leucopaxillus consiste di specie cosmopolite con basidiomi generalmente terricoli. Esso è caratterizzato da un habitus clitocyboide o tricholomatoide; un cappello da convesso a leggermente depresso; lamelle da adnate a decorrenti, facilmente separabili dalla carne del cappello; veli generalmente assenti; sporata da bianca a giallastra chiara; pileipellis da cutis a trichoderma; spore ialine, da lisce a verrucolose, le spore lisce debolmente amiloidi [sottogenere Aspropaxillus (Kühner & Maire 1934) Bon 1990 = Sezione Aspropaxilli (Kühner & Maire 1934) Singer & A.H. Sm. 1943], le spore verrucose con ornamentazione fortemente amiloide e senza una plaga ben differenziata (Sottogenere Leucopaxillus = Sezione Leucopaxillus); cheilocistidi assenti o ifoidi (non ben sviluppati); giunti a fibbia presenti (SINGER & SMITH, 1943; PEGLER & YOUNG, 1973; SINGER 1986; BON 1991; GULDEN 1992; NOORDELOOS 1984, 1995; CONSIGLIO & CONTU, 2000; HORAK, 2005; CHRISTENSEN, 2008; WATLING & TURNBULL, 2008; VIZZINI 2009). Melanoleuca, un Genere morfologicamente apparentato, differisce da Leucopaxillus principalmente per la mancanza di giunti a fibbia, per le spore con una plaga ben differenziata e, generalmente, per i cistidi imeniali con parete spessa ben sviluppati (SINGER, 1986; BON, 1978, 1991; BOEKHOUT, 1999). Inquadramento della nuova specie secondo la tassonomia tradizionale Pur presentando connotati macro- e microscopici simili a quelli di diverse specie di Leucopaxillus, L. agrippinae occupa una posizione isolata nel Genere, perché non possiede giunti a fibbia. Se si desse un’importanza fondamentale a questo carattere, la nostra specie dovrebbe essere inquadrata nel Genere Melanoleuca! Inversamente, per la presenza di giunti a fibbia, Melanoleuca nigrescens (Bres.) Bon è stata ricombinata nel Genere Leucopaxillus (FONTENLA & PARA, 2007) come Leucopaxillus mirabilis var. nigrescens Fontenla & Para. La presenza di giunti a fibbia come carattere determinante per la delimitazione di una specie è stata recentemente messa in discussione dai risultati dell’analisi molecolare di alcune raccolte del complesso Haasiella splendidissima/H. venustissima CONSIGLIO ET AL., 2011; VIZZINI ET AL., 2011). Essi indicano che i due taxa devono essere considerati conspecifici, H. splendidissima rappresentando soltanto una popolazione tetrasporica, dotata di giunti a fibbia e con un ciclo di vita eterotallico, di H. venustissima. Facendo dunque astrazione dall’assenza di giunti a fibbia, nell’ipotesi che L. agrippinae possa rappresentare una variante omotallica di una specie fibbiata, non ancora trovata, e adottando il sistema tassonomico di BON (1991), modificato da CONSIGLIO & CONTU (2000), questa specie dovrebbe trovare la sua naturale collocazione nel Sottogenere Leucopaxillus, per le spore ornate da verruche amiloidi, nella Sezione Mirabiles Bon 1990, per la presenza di cellule marginali abbondanti, ben differenziate, e nella Sottosezione Mirabilini (“Mirabilinae”) Bon 1978 ex Bon 1990, per la presenza sul gambo di una zona pseudoanulare araneosocotonosa subito sotto le lamelle. I caratteri più salienti di L. agrippinae sono il portamento prettamente clitocyboide; la cuticola del cappello integra, di colore giallo-ocra, aranciata in esemplari adulti; l’imenoforo non lineare, di aspetto anastomizzato-labirintiforme, con lamelle fortemente decorrenti; il gambo provvisto di una zona pseudoanulare araneoso-cotonosa; la carne amarissima; le spore misuranti 6,8-8,4 × 4,6-5,7 μm, da ellissoidali a lungamente ellissoidali, con verruche rade, larghe e piuttosto alte; gli pseudocistidi filiformi, cilindracei, ricoprenti a ciuffi il taglio lamellare e frammisti a numerose cellule sterili di varia conformazione; l’assenza di giunti a fibbia in ogni parte del basidioma. Per quanto detto sopra L. agrippinae presenta notevoli affinità con L. mirabilis (Bres.) Konrad & Maubl. var. mirabilis e con L. mirabilis var. nigrescens. Peraltro, alcune specie con le quali L. agrippinae potrebbe presentare una certa somiglianza sono: L. alboalutaceus (F.H. Møller & Jul. Schäff.) F.H. Møller [= L. lentus s. Kühner & Romagn.; = L. baeospermus Kühner] ritenuto da SINGER & SMITH (1943) una forma apigmentata di L. amarus (Alb. & Schwein. : Fr.) Kühner [= L. gentianeus (Quél.) Kotl.], che presenta un imenoforo lineare con lamelle sinuate o subdecorrenti, sfumate di crema-rosato a maturità; gambo senza zona pseudoanulare; carne appena amara; spore più piccole, da largamente ellissoidali a subglobose. L. paradoxus (Costantin & L.M. Dufour) Boursier f. paradoxus dal portamento tricholomatoide con cappello carnoso; cuticola appena screpolato-areolata al disco, inizialmente di colore bianco candido, poi con delle lievi sfumature gialloocra nella zona centrale; imenoforo lineare con lamelle biancastre, decorrenti e fortemente anastomizzate sul gambo; zona pseudoanulare assente; carne con odore aromatico fungino-floreale (fiori di agrumi), spesso con note sgradevoli e sapore dolciastro; generalmente privo di cheilocistidi. L. paradoxus f. cutefractus (Noordel.) Vizzini, con cappello finemente screpolato al margine o addirittura interamente squamuloso-areolato; imenoforo lineare con lamelle bianche, poco anastomizzate all’inserzione con il gambo; gambo senza zona pseudoanulare; carne non amara; crescita prevalentemente in terreni sabbiosi. L. cerealis (Lasch) Singer [= L. albissimus (Peck) Singer] interamente di colore bianco con lievi sfumature crema-ocra al disco; imenoforo lineare con lamelle fitte, non o appena anastomizzate alla sommità del gambo; zona pseudoanulare assente; carne bianca, immutabile con odore debolmente aromatico e sapore amaro; generalmente privo di cheilocistidi. L. barbarus (Maire) Kühner di piccole dimensioni; cappello bianco con sfumature ocracee al disco; imenoforo lineare con lamelle bianche, fitte, decorrenti, non anastomizzate; gambo privo di zona pseudoanulare; carne con odore gradevole e sapore dolce; verruche sporale sottili e debolmente amiloidi; cheilocistidi assenti. Per quanto detto sopra, l’assenza di giunti a fibbia pone L. agrippinae in una posizione isolata nel Genere Leucopaxillus (vedi anche dopo, nel capitolo Tassonomia molecolare). Tassonomia molecolare - Allineamento delle sequenze e analisi filogenetica Le sequenze ITS incluse nell’analisi filogenetica sono state ricavate dai database GenBank e UNITE, in accordo con alcuni studi recenti (MONCALVO ET AL., 2002; MATHENY ET AL., 2006; VIZZINI ET AL, 2012). L’allineamento è stato gene-rato usando MAFFT v6.814b (KATOH ET AL., 2002) con le condizioni di default per l’apertura e l’estensione dei gap. L’allineamento è stato poi editato usando MEGA 5.0 (TAMURA ET AL., 2011). L’analisi molecolare filogenetica è stata effettuata tramite l’algoritmo di Maximum Likelihood (ML), attraverso il software RAxML (STAMATAKIS, 2006). L’analisi è stata condotta secondo il modello evolutivo GTR + (funzione -m GTRGAMMA) e sono state effettuate 1000 repliche di bootstrap (FELSENSTEIN, 1985) per la ricerca dell’avvaloramento statistico della migliore topologia trovata. I valori di supporto statistico di bootstrap (MLB) superiori al 50% sono stati riportati sull’albero in corrispondenza dei nodi dei rami (Fig. 1). Xeromphalina campanella (Batsch : Fr.) Maire (Clado Hygrophoroide, numero di accesso GenBank GU320006) è stata usata come taxon outgroup. Risultati e Discussione Secondo recenti analisi molecolari (MONCALVO ET AL., 2000, 2002; MATHENY ET AL., 2006; VIZZINI ET AL., 2011A), Melanoleuca e Leucopaxillusnon sono strettamente correlati dal punto di vista filogenetico: le specie di Melanoleuca si raggruppano all’interno del clado Pluteoide (Pluteaceae Kotl. & Pouzar in parte, Amanitaceae R. Heim ex Pouzar, Lymnoperdaceae G.A. Escobar, Macrocystidiaceae Kühner, Pleurotaceae Kühner) (MONCALVO ET AL., 2002; BODENSTEINER ET AL., 2004; BINDER ET AL., 2006; MATHENY ET AL., 2006; VIZZINI ET AL., 2011A), mentre Leucopaxillusappartiene al clado Tricholomatoide (Tricholomataceae s. str., assiemea Clitocybe (Fr.) Staude, Collybia (Fr.) Staude, Lepista (Fr.) W.G. Sm.,Tricholoma (Fr.) Staude e altri Generi minori (MONCALVO ET AL., 2002; MATHENY ET AL., 2006; VIZZINI ET AL., 2012). Le specie di Leucopaxillus sequenziate erano, fino a non molto tempo addietro, molto poche. Uno studio (VIZZINI ET AL., 2012), basato su un set di sequenze ITS-LSU più ampio, è stato il primo a esaminare questo Genere estensivamente; le analisi hanno dimostrato che Leucopaxillus, così come circoscritto su base morfologica (per esempio, SINGER, 1986; BON, 1991), è un genere polifiletico. Risulta evidente che gli aspetti “leucopaxilloidi” (basidiomi con habitus clitocyboide o tricholomatoide, giunti a fibbia e spore con ornamentazioni amiloidi) hanno dato origine a diverse linee evolutive più o meno indipendenti. In VIZZINI ET AL. (2012) sono stati proposti i nuovi Generi Giacomia Vizzini & Contu, Notholepista Vizzini & Contu e Pseudoclitopilus Vizzini & Contu, rispettivamente, per Leucopaxillus mirabilis, L. subzonalis (Peck) H.E. Bigelow e L. rhodoleucus (Romell) Kühner ed è stata riconosciuta l’indipendenza del Genere Aspropaxillus Kühner & Maire. Le analisi molecolari mostrano chiaramente (Fig. 1) che L. agrippinae le cui sequenze erano state indicate in VIZZINI ET AL. (2012) comeLeucopaxillus sp. 1 (JQ639159) e Leucopaxillus sp. 2 (JQ639160)], appartiene a Leucopaxillus s. str. ed è distinto da L. cerealis, L. monticola (Singer & A.H. Sm.) Bon e L. paradoxus (specie tipo del genere). Risulta anche evidente che le raccolte di L. agrippinae esaminate sono rappresentative di un taxon non ancora descritto caratterizzato da basidiomi con zona pseudoanulare, senza fibbie e da basidi principalmente bisporici. È abbastanza sorprendente che, malgrado le affinità di L. agrippinae con i taxa della Sezione Mirabiles (velo parziale araneoso-cotonoso, che forma un sottile anello, e cheilocistidi abbondanti), esso trovi collocazione, su base molecolare, nella Sezione Leucopaxillus (Genere Leucopaxillus s. str.) e non nel Genere Giacomia. Questo indica che lo sviluppo di un velo parziale e di cheilocistidi è avvenuto più volte (almeno due) e in modo indipendente nell’ambito dei taxa “leucopaxilloidi” e che tali caratteri non sono indicativi di affinità filogenetica. Ringraziamenti Ringraziamo sentitamente, per la preziosa collaborazione, Pierre-Arthur Moreau (Université de Lille, France). Riferimenti Bibliografici BINDER M., D.S. HIBBETT, Z. WANG & W. FARNHAM - 2006: Evolutionary relationships of Mycaureola dilseae (Agaricales), a basidiomycete pathogen of a subtidal rhodophyte. American Journal of Botany 93: 547-556. BODENSTEINER P., M. BINDER, J.-M. MONCALVO, R. AGERER, D.S. HIBBETT - 2004: Phylogenetic relationships of cyphelloid homobasidiomycetes. Molecular Phylogenetics and Evolution 33: 501-515. BOEKHOUT T. - 1999: Melanoleuca Pat. In: C. Bas, Th.W. Kuyper, M.E. Noordeloos, E.C. Vellinga (eds.). Flora Agaricina Neerlandica 4. Balkema, Rotterdam: 153-165. BON M. - 1978: Tricholomataceae de France et d’Europe occidentale (Leucopaxilloideae). Documents Mycologiques 9 (33): 1-79. BON M. - 1990: Taxons nouveaux et validations. Documents Mycologiques 20 (79): 57-62. BON M. - 1991: Tricholomataceae (Fayod) Heim (1ère partie) (Tricholomoideae et Leucopaxilloideae). Flore Mycologique d’Europe Vol. 2. Les Tricholomes et Ressemblants. Documents Mycologiques Mémoire Hors Série. Amiens, 163 pp. BOURSIER J. - 1925: Leucopaxillus gen. nov. Bull. Soc. mycol. Fr. 41 (3): 391-393. CHRISTENSEN M. - 2008: Leucopaxillus Boursier. In: H. Knudsen & J. Vesterholt (eds.). Funga Nordica. Nordsvamp, Copenhgen: 409-411. CONSIGLIO G. & M. CONTU M. - 2000: Il genere Leucopaxillus Boursier in Italia, con brevi note sulle rimanenti specie europee. Bollettino della Associazione Micologica Ecologica Romana 51: 3-36. CONSIGLIO G. & L. SETTI - 2008: Il Genere Crepidotus in Europa. A.M.B. Fondazione Centro Studi Micologici. Trento. CONSIGLIO G., L. SETTI & A. VIZZINI - 2011: Contributo alla conoscenza del Genere Haasiella. Rivista di Micologia 3: 221-232. FANNECHÉRE G. - 2011: Mycomètre, logiciel d’aide à la mesure et de traitement statistique. http://mycolim.free....htm FELSENSTEIN J. - 1985: Confidence limits on phylogenies: an approach using the bootstrap. Evolution 39: 783-791. FONTENLA R. & R. PARA - 2007: Osservazioni sul Genere Melanoleuca. Studio dei typi - I. Rivista di Micologia 3: 221-236. GULDEN G. - 1992: Leucopaxillus Bours. In: L. Hansen, H. Knudsen (eds.). Nordic Macromycetes 2. Nordsvamp, Copenhagen: 135-136. HEIM R. - 1934: Fungi Iberici. Mus. barcin. Scient. nat. Op., Ser. Bot. 15 (3): 1-146.KATOH. K., K. MISAWA, K. KUMA & T. MIYATA - 2002: MAFFT: a novel method for rapid multiple sequence alignment based on fast Fourier transform. Nucleic Acids Research 30, 3059-3066. KIRK P.M. & A.E. ANSELL - 1992: Authors of fungal names. Index of fungi supplement. International Mycological Institute. C.A.B. International. KÜHNER R. & R. MAIRE - 1934: Étude de la réaction de la membrane sporique à l’ iode dans les divers genres d’Agarics leucosporés. Bulletin Trimestriel de la Société Mycologique de France 50: 9-24. MATHENY P.B., J.M. CURTIS, V. HOFSTETTER, M.C. AIME, J.-M. MONCALVO J.-M., F.M. LUTZONI, S.A. REHNER, J. JOHNSON, R. VILGALYS - 2000: Phylogenetic relationships of agaric fungi based on nuclear large subunit ribosomal DNA sequences. Systematic Biology 49: 278-305. MONCALVO, Z.-W. GE, Z-L. YANG, J.C. SLOT, J.F. AMMIRATI, T.J. BARONI, N.L. BOUGHER, K.W. HUGHES, D.J. LODGE, R.W. KERRIGAN, M.T. SEIDL, D.K. AANEN, M. DENITIS, G.M. DANIELE, D.E. DESJARDIN, R. KROPP, L.L. NORVELL, A. PARKER, E.C. VELLINGA, R. VILGALYS, D.S. HIBBETT - 2006: Major clades of Agaricales: a multilocus phylogenetic overview. Mycologia 98: 982-995. NOORDELOOS M.E.- 1984: Notulae ad Floram Agaricinam Neerlandicam. IV-V. Clitopilus and Leucopaxillus. Persoonia 12: 155-167. NOORDELOOS M.E. - 1995: Leucopaxillus Boursier. In: C. Bas, Th.W. Kuyper, M.E. Noordeloos, E.C. Vellinga (eds.). Flora Agaricina Neerlandica 3. Balkema, Rotterdam: 76-77. PEGLER D.N. & T.W.K. YOUNG - 1973: Basidiospore form in the British Leucopaxilleae. Kew Bulletin 28: 365-379. POUZAR Z. - 1983: Taxonomic and nomenclatural notes on some families of larger fungi. eská Mykol. 37: 172-176. SINGER R. - 1948: Diagnoses Fungorum Novorum Agaricalium. Sydowia 2: 26-42. SINGER R. - 1986: The Agaricales in modern taxonomy, 4th edn. Koeltz Scientific Books. Koenigstein. SINGER R. & A.H. SMITH - 1943: A monograph on the genus Leucopaxillus Boursier. Papers of the Michigan Academy of Science, Arts & Letters 28: 85-132. STAMATAKIS A - 2006: RAxML-VI-HPC: Maximum likelihood-based phyloge-netic analyses with thousands of taxa and mixed models. Bioinformatics 22: 2688-2690. TAMURA K., D. PETERSON, N. PETERSON, G. STECHER, M. NEI & S. KUMAR - 2011: MEGA5: Molecular Evolutionary Genetics Analysis using Maximum Likelihood, Evolutionary Distance, and Maximum Parsimony Methods. Molecular Biology and Evolution 28: 2731-2739. UNDERWOOD L.M. - 1899: Moulds, mildews and mushrooms. A guide to the systematic study of the Fungi and Mycetozoa and their literature. New York. VIZZINI A. - 2009: Revisione dei generi Armillaria, Crinipellis, Chaetocalathus, Leucopaxillus e Omphalotus. In: Maire J-C, Moreau P-A, Robich G (eds.). Compléments à la Flore des champignons supérieurs du Maroc de G. Malençon et R. Bertault. Confédération Européenne de Mycologie Méditerranéenne, Nice: 419-446. VIZZINI A., E. ERCOLE & M. CONTU - 2012: A contribution to the ITS-LSU phylogeny of the genus Leucopaxillus (/tricholomatoid clade, Agaricales), with three new genera and notes on Porpoloma. Mycosphere 3 (1): 79-90. VIZZINI A., G. CONSIGLIO, L. SETTI & E. ERCOLE - 2012: The phylogenetic position of Haasiella (Basidiomycota, Agaricomycetes) and the relationships between H. venustissima and H. splendidissima. Mycologia 104 (3): 777-784. VIZZINI A., R. PARA, R. FONTENLA, S. GHIGNONE & E. ERCOLE - 2011a: A preliminary ITS phylogeny of Melanoleuca (Agaricales), with special reference to European taxa. Mycotaxon 118: 361-381. WATLING R. & E. TURNBULL - 1998: Cantharellaceae, Gomphaceae and amyloid-spored and xeruloid members of Tricholomataceae (excl. Mycena). British Fungus Flora, Agarics and Boleti 8. Royal Botanic Gardens, Edinburgh. Scheda e articolo scientifico realizzato da ANDREA BUDA, GIOVANNI CONSIGLIO, LEDO SETTI, ENRICO ERCOLE, ALFREDO VIZZINI, la pubblicazione nel Forum dell'Associazione Micologica AMINT è stata autorizzata direttamente dall'Autore Andrea Buda. L'articolo originale è pubblicato su: BUDA A. et. al. 2012. Leucopaxillus agrippinae, una nuova specie raccolta in Sicilia. RdM, 2: 99-114.